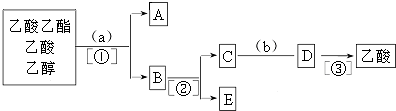
题目内容
15.设 NA为阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 0.5mol/L MgCl2溶液中,含有Cl-离子数为NA | |
| C. | 2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 1mol碳正离子(CH 3+)所含的电子总数为9NA |
分析 A、氧气和臭氧均由氧原子构成;
B、溶液体积不明确;
C、其所处的状态不明确;
D、碳正离子中含8个电子.
解答 解:A、氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量为2mol,故含2NA个,故A正确;
B、溶液体积不明确,故溶液中的氯离子的个数无法计算,故B错误;
C、其所处的状态不明确,故气体的物质的量无法计算,则含有的碳原子个数无法计算,故C错误;
D、碳正离子中含8个电子,故1mol碳正离子中含8NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
5.将醋酸钠饱和溶液加热( )
| A. | 碱性增强 | B. | 碱性不变 | C. | pH不变 | D. | 碱性变弱 |
3.燃料电池是燃料(如甲烷等)跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如KOH )溶液,下列关于甲烷燃料电池的说法中不正确的是( )
| A. | 负极的电极反应式为:CH4+10OH--8e-═CO32-+7H2O | |
| B. | 通入氧气的一极发生氧化反应,通入甲烷的一极发生还原反应 | |
| C. | 随着反应的进行,电解质溶液的pH增大 | |
| D. | 甲烷燃料电池的能量利用率比甲烷燃烧的大 |
10.下列化合物中,阳离子半径与阴离子半径比值最小的是( )
| A. | NaI | B. | NaBr | C. | MgI2 | D. | KBr |
5.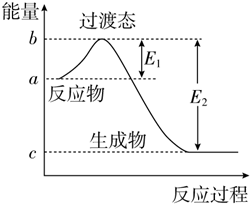 如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )
如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )
 如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )
如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )| A. | 若在反应体系中加入催化剂,E1不变 | |
| B. | 若在反应体系中加入催化剂,△H减小 | |
| C. | 反应的活化能等于y kJ•mol-1 | |
| D. | 1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x-y) kJ•mol-1 |

 .
. .
. .
.