题目内容
4.现有乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作步骤流程图.请回答下列问题: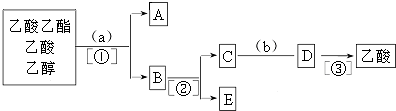
(1)加入试剂:a饱和Na2CO3溶液,b浓硫酸.
(2)分离方法:①分液,②蒸馏.
(3)物质名称:A乙酸乙酯.
分析 由分离流程可知,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,以此来解答.
解答 解:乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可,即①为分液.A为乙酸乙酯,B为碳酸钠溶液,吸收乙醇、除去乙酸,对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇,则②为蒸馏.然后C中水层含乙酸钠,根据强酸制弱酸,要用b(浓硫酸)反应得到乙酸,再蒸馏得到乙酸,
(1)由上述分析可知,试剂a、b分别为饱和Na2CO3溶液、,故答案为:饱和Na2CO3溶液;浓硫酸;
(2)分离方法①、②分别为分液、蒸馏,故答案为:分液;蒸馏;
(3)由上述分析可知A为乙酸乙酯,故答案为:乙酸乙酯.
点评 本题考查混合物分离提纯,为高频考点,把握混合物分离流程、分离方法及发生的反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.短周期主族元素W、R、X、Y、Z的原子序数依次增大,W的原子半径是周期表中所有元素中最小的,R是地壳中含量最多的元素,X与W同主族,Y最外层电子数是最内层电子数的3倍.下列说法正确的是( )
| A. | 原子半径:R<Z<Y | B. | 简单氢化物的热稳定性:R>Y | ||
| C. | R与Y只能形成一种化合物 | D. | 最高价氧化物的水化物酸性:Y>Z |
15.设 NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 0.5mol/L MgCl2溶液中,含有Cl-离子数为NA | |
| C. | 2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 1mol碳正离子(CH 3+)所含的电子总数为9NA |
19.可以证明乙醇分子中有一个氢原子与其他氢原子不同的方法是( )
| A. | 乙醇代替汽油作燃料,污染小,更环保 | |
| B. | 1mol 乙醇燃烧生成3mol水 | |
| C. | 1mol 乙醇与足量Na反应生成0.5 mol H2 | |
| D. | 乙醇可以制饮料 |
16.生产泡沫橡胶过程中,有如下一个反应:2H2O2=2H2O+O2↑.有关该反应的说法正确的是( )
| A. | 该反应是个放热反应 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | H2O2仅为氧化剂 | |
| D. | H2O2既是氧化剂又是还原剂 |
14.向盛有FeCl3溶液的试管中滴入KSCN溶液,溶液呈( )
| A. | 无色 | B. | 红色 | C. | 蓝色 | D. | 浅绿色 |
 分子中,处于同一平面上的原子数最多可能有16个.
分子中,处于同一平面上的原子数最多可能有16个.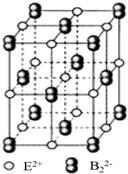 原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.
原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.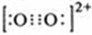 ;1mol D22+中含有的π键数目为2NA.
;1mol D22+中含有的π键数目为2NA.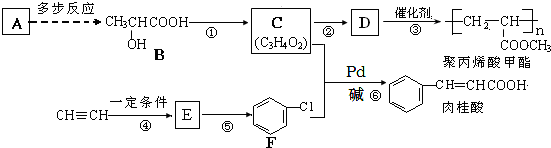
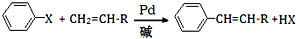 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)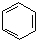 ;反式肉桂酸的结构简式为
;反式肉桂酸的结构简式为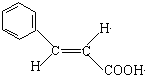 .
.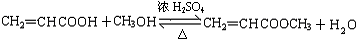 ;
;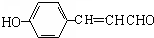 (写结构简式).
(写结构简式).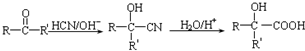 ,设设计由A(C2H4)制备B的合成路线(无机试剂任选):
,设设计由A(C2H4)制备B的合成路线(无机试剂任选):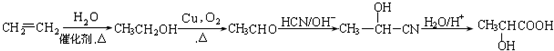 .
.