题目内容
9.某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入过量稀盐酸,沉淀没变化.
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况).
下列说法正确的是( )
| A. | 该固体中一定含有NH4+、SO42-、Na+ | |
| B. | 该固体中一定没有Cu2+、Cl- | |
| C. | 该固体中只含有NH4+、CO32-、SO42-、Cl- | |
| D. | 根据以上实验,无法确定该固体中有Na+ |
分析 (1)一份固体溶于水得无色透明溶液,说明不含Cu2+,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入过量稀盐酸,沉淀没变化,说明沉淀不溶于盐酸,一定含有SO42-,一定不含CO32-,且n(SO42-)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol;
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体,即氨气0.672L即0.03mol(标准状况),所以含有铵根离子0.03mol,以此解答该题.
解答 解:(1)一份固体溶于水得无色透明溶液,说明不含Cu2+,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入过量稀盐酸,沉淀没变化,说明沉淀不溶于盐酸,一定含有SO42-,一定不含CO32-,且n(SO42-)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol;
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体,即氨气0.672L即0.03mol(标准状况),所以含有铵根离子0.03mol,A.n(SO42-)=0.02mol,n(NH4+)=0.03mol阴离子所带电荷大于阳离子所带电荷,由电荷守恒可知应还存在Na+,故A正确;
B.因Na+的量不能确定,则不能确定是否含有Cl-,故B错误;
C.由以上分析可知不存在CO32-,Cl-不能确定,故C错误;
D.由A分析可知一定存在Na+,故D错误.
故选A.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意掌握电荷守恒在离子推断中的应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
19.图是某有机物的1H核磁共振谱图,则该有机物可能是( )
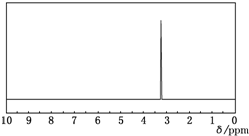

| A. | CH3CH2OH | B. | CH3CH2CH2OH | C. | CH3-O-CH3 | D. | CH3CHO |
20.如图是石蜡油(液态烷烃混合物)在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验.下列有关说法错误的是( )
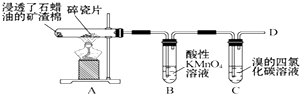

| A. | A装置中碎瓷片的作用是做催化剂 | B. | B、C试管中的溶液均要褪色 | ||
| C. | B、C试管中均发生的是加成反应 | D. | 在D处点燃前,一定要先验纯 |
17.下列化学用语的书写,正确的是( )
| A. | 氮气的电子式: | B. | 溴化钠的电子式: | ||
| C. | 乙醛的结构简式:CH2COH | D. | 次氯酸的化学式:HClO |
4.下列离子方程式正确的是( )
| A. | 二氧化锰和浓盐酸反应:MnO2+4HCl浓═Mn2++2Cl2↑+2H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2 Na++2OH-═Na2SiO3+H2O | |
| C. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ |
1.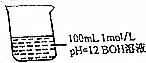 常温下对图中溶液分别进行下列操作,相关分析正确的是( )
常温下对图中溶液分别进行下列操作,相关分析正确的是( )
 常温下对图中溶液分别进行下列操作,相关分析正确的是( )
常温下对图中溶液分别进行下列操作,相关分析正确的是( )| A. | 稀释10倍,溶液中n(H+)•n(OH-)不变 | |
| B. | 加人100mL pH=2的盐酸,溶液中存在c(Cl-)=c(B+) | |
| C. | 加入少量BCl固体,固体溶解后溶液pH不变(忽略溶液体积变化) | |
| D. | 若升高温度,$\frac{c({B}^{+})+c({H}^{+})}{c(0{H}^{-})}$保持不变 |
8.下列关于化学键的说法,正确的是( )
| A. | 由非金属元素组成的化合物不一定是共价化合物 | |
| B. | 离子化合物可能含共价键,共价化合物可能含离子键 | |
| C. | 任何单质中一定含共价键 | |
| D. | 离子键的本质就是阴阳离子间的静电引力 |
 如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5mL稀盐酸于试管中.试回答下列问题:
如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5mL稀盐酸于试管中.试回答下列问题: