题目内容
20.如图是石蜡油(液态烷烃混合物)在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验.下列有关说法错误的是( )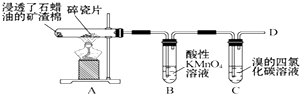
| A. | A装置中碎瓷片的作用是做催化剂 | B. | B、C试管中的溶液均要褪色 | ||
| C. | B、C试管中均发生的是加成反应 | D. | 在D处点燃前,一定要先验纯 |
分析 石蜡油在高温条件下发生裂解生成乙烯,B为高锰酸钾,可与乙烯发生氧化还原反应,C为溴的四氯化碳溶液,可与乙烯发生加成反应,D为饱和烃,以此解答该题.
解答 解:A.石蜡油在炽热碎瓷片的作用下产生乙烯,所以其作用主要是催化,加快反应速率,故A正确;
B.乙烯含有碳碳双键,可与高锰酸钾发生氧化还原反应、与溴发生加成反应,则B、C试管中的溶液均要褪色,故B正确;
C.B发生的为氧化还原反应,故C错误;
D.不纯的可燃气体易爆炸,点燃前,一定要先验纯,故D正确.
故选C.
点评 本题考查了乙烯的性质实验设计,为高频考点,侧重于学生的分析、实验能力的考查,注意乙烯能发生氧化反应、加成反应的性质,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
11.在 溶液中能大量共存且溶液为无色透明的离子组是( )
| A. | K+、MnO4-、Na+、Cl- | B. | Fe3+、Na+、Cl-、SO42- | ||
| C. | Na+、H+、NO3-、SO42- | D. | K+、Na+、NO3-、Cu2+ |
8.用pH大小表示溶液的酸碱性相对强弱有许多不足之处.荷兰科学家Henk Van Lubeck 引入了酸度(AG)的概念,即把酸度定义为c(H+)与c(OH-)比值的对数,用公式表示为AG=lg[c(H+)/c(OH-)].下列有关叙述中,正确的是( )
| A. | 在25℃时,AG=10的溶液呈碱性 | |
| B. | 在25℃时,若溶液呈中性,则pH=7,AG=1 | |
| C. | 在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH) | |
| D. | 在25℃时,0.1 mol•L-1 NaOH溶液AG=0 |
15.下列方法中,不能实现海水淡化的是( )
| A. | 蒸馏法 | B. | 电渗析法 | C. | 过滤法 | D. | 离子交换法 |
12.下列各组物质中,能用高锰酸钾酸性溶液鉴别的是( )
| A. | 乙烯、乙炔 | B. | 己烯、苯 | C. | 苯、己烷 | D. | 苯、甲苯 |
9.某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入过量稀盐酸,沉淀没变化.
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况).
下列说法正确的是( )
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入过量稀盐酸,沉淀没变化.
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况).
下列说法正确的是( )
| A. | 该固体中一定含有NH4+、SO42-、Na+ | |
| B. | 该固体中一定没有Cu2+、Cl- | |
| C. | 该固体中只含有NH4+、CO32-、SO42-、Cl- | |
| D. | 根据以上实验,无法确定该固体中有Na+ |
20.下列操作中能使电离平衡H2O?H++OH-,向右移动且溶液呈酸性的是( )
| A. | 将水加热到100℃,使pH=6 | B. | 向水中加入Al2(SO4)3固体 | ||
| C. | 向水中加入Na2CO3溶液 | D. | 向水中加入NaHSO4溶液 |