题目内容
1.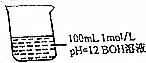 常温下对图中溶液分别进行下列操作,相关分析正确的是( )
常温下对图中溶液分别进行下列操作,相关分析正确的是( )| A. | 稀释10倍,溶液中n(H+)•n(OH-)不变 | |
| B. | 加人100mL pH=2的盐酸,溶液中存在c(Cl-)=c(B+) | |
| C. | 加入少量BCl固体,固体溶解后溶液pH不变(忽略溶液体积变化) | |
| D. | 若升高温度,$\frac{c({B}^{+})+c({H}^{+})}{c(0{H}^{-})}$保持不变 |
分析 1mol/L的BOH的pH=12,c(OH-)=0.01mol/L,说明BOH为弱碱.
A.加水稀释,促进BOH的电离,溶液中c(H+)•c(OH-)不变,以此判断n(H+)•n(OH-)的变化;
B.加人100mL pH=2的盐酸,完全反应,BOH过量,溶液呈碱性,结合电荷守恒判断;
C.加入少量BCl固体,抑制BOH的电离;
D.结合电荷守恒判断.
解答 解:1mol/L的BOH的pH=12,c(OH-)=0.01mol/L,说明BOH为弱碱.
A.加水稀释,促进BOH的电离,溶液体积增大,因c(H+)•c(OH-)不变,则n(H+)•n(OH-)增大,故A错误;
B.BOH为弱碱,加人100mL pH=2的盐酸,BOH过量,溶液呈碱性,因存在c(Cl-)+c(OH-)=c(B+)+c(H+),c(H+)<c(OH-),则c(Cl-)<c(B+),故B错误;
C.因BOH为弱碱,加入少量BCl固体,抑制BOH的电离,固体溶解后溶液pH减小,故C错误;
D.溶液中存在c(OH-)=c(B+)+c(H+),则无论是否升高温度,$\frac{c({B}^{+})+c({H}^{+})}{c(0{H}^{-})}$都保持不变,故D正确.
故选D.
点评 本题考查弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,注意把握弱电解质电离的特点以及影响平衡移动的因素,把握电荷守恒的运用,难度中等.

练习册系列答案
相关题目
11.在 溶液中能大量共存且溶液为无色透明的离子组是( )
| A. | K+、MnO4-、Na+、Cl- | B. | Fe3+、Na+、Cl-、SO42- | ||
| C. | Na+、H+、NO3-、SO42- | D. | K+、Na+、NO3-、Cu2+ |
12.下列各组物质中,能用高锰酸钾酸性溶液鉴别的是( )
| A. | 乙烯、乙炔 | B. | 己烯、苯 | C. | 苯、己烷 | D. | 苯、甲苯 |
9.某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入过量稀盐酸,沉淀没变化.
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况).
下列说法正确的是( )
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入过量稀盐酸,沉淀没变化.
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况).
下列说法正确的是( )
| A. | 该固体中一定含有NH4+、SO42-、Na+ | |
| B. | 该固体中一定没有Cu2+、Cl- | |
| C. | 该固体中只含有NH4+、CO32-、SO42-、Cl- | |
| D. | 根据以上实验,无法确定该固体中有Na+ |
16.取ag某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量小于ag的是( )
| A. | C2H4O4 | B. | CO | C. | C6H12O6 | D. | C12H22O11 |
6.下列反应中,属于非氧化还原反应的是( )
| A. | 3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | 3Cl2+6KOH═5KCl+KClO3+3H2O | |
| C. | 3H2O2+2KCrO2+2KOH═2K2CrO4+4H2O | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
20.下列操作中能使电离平衡H2O?H++OH-,向右移动且溶液呈酸性的是( )
| A. | 将水加热到100℃,使pH=6 | B. | 向水中加入Al2(SO4)3固体 | ||
| C. | 向水中加入Na2CO3溶液 | D. | 向水中加入NaHSO4溶液 |
 .
.