题目内容
14.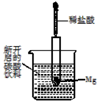 如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5mL稀盐酸于试管中.试回答下列问题:
如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5mL稀盐酸于试管中.试回答下列问题:(1)实验中观察到的现象是 ①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中溶液变浑浊.
(2)产生上述现象的原因是镁与盐酸反应产生H2,该反应为放热反应,Ca(OH)2在水中溶解度随温度升高而减小
(3)由实验推知,MgCl2溶液和氢气的总能量小于(填“大于”“小于”或“等于”)镁片和盐酸的总能量.
分析 如图所示的实验中,所试管内滴入稀盐酸,盐酸与镁剧烈反应放出氢气,同时反应放出的热量使饱和石灰水溶液温度升高,温度升高氢氧化钙溶解度减小,饱和溶液析出固体氢氧化钙而使溶液看上去变浑浊;碳酸在溶液中不稳定分解生成二氧化碳气体.
解答 解:(1)镁与盐酸剧烈反应,可观察到产生大量气体,反应放出热量使饱和溶液温度升高,析出固体溶质,观察到溶液变浑浊,
故答案为:烧杯中溶液变浑浊;
(2)镁与盐酸剧烈反应,产生氢气并放出大量的热,由于氢氧化钙的溶解度随温度升高而减小,所以饱和石灰水升温后析出的氢氧化钙使溶液呈浑浊状,
故答案为:镁与盐酸反应产生H2,该反应为放热反应,Ca(OH)2在水中溶解度随温度升高而减小;
(3)当反应物的能量高于生成物的能量时,反应是放热反应,故MgCl2溶液和H2的总能量小于镁片的盐酸的总能量,故答案为:小于.
点评 本题考查了化学反应现象和能量变化分析,注意分析通过化学变化放热而使饱和溶液温度升高,氢氧化钙的饱和溶液中,氢氧化钙溶解度随温度升高而减小的,掌握特征和基础是解决问题的关键,题目难度中等.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
4.有关下列化合物的叙述正确的是( )
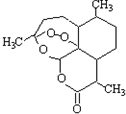

| A. | 分子式为:C16H22O5 | |
| B. | 该化合物中含有过氧键,一定条件下有氧化性 | |
| C. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| D. | 该化合物与维生素一样是水溶性的 |
2.下列说法不正确的是( )
| A. | 某试样焰色反应呈黄色,则试样中一定含有Na+ | |
| B. | 精密pH试纸测得某碱性溶液的pH为12.5 | |
| C. | 容量瓶不能用作溶解物质的容器 | |
| D. | 粗盐的提纯试验中,滤液在蒸发皿中加热蒸发结晶 |
9.某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入过量稀盐酸,沉淀没变化.
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况).
下列说法正确的是( )
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入过量稀盐酸,沉淀没变化.
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况).
下列说法正确的是( )
| A. | 该固体中一定含有NH4+、SO42-、Na+ | |
| B. | 该固体中一定没有Cu2+、Cl- | |
| C. | 该固体中只含有NH4+、CO32-、SO42-、Cl- | |
| D. | 根据以上实验,无法确定该固体中有Na+ |
19.存在下列反应:2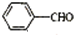 +NaOH→
+NaOH→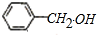 +
+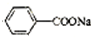 ,据此反应,以下说法正确的是( )
,据此反应,以下说法正确的是( )
 +NaOH→
+NaOH→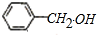 +
+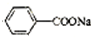 ,据此反应,以下说法正确的是( )
,据此反应,以下说法正确的是( )| A. | 该反应为氧化还原反应 | B. | 苯甲醛只还原苯甲醇 | ||
| C. | 苯甲醛只氧化为苯甲酸 | D. | 苯甲醛既是氧化剂又是还原剂 |
6.下列反应中,属于非氧化还原反应的是( )
| A. | 3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | 3Cl2+6KOH═5KCl+KClO3+3H2O | |
| C. | 3H2O2+2KCrO2+2KOH═2K2CrO4+4H2O | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
13.下列说法正确的是( )
| A. | 明矾具有杀菌消毒作用,可用于净水 | |
| B. | 烧碱不是碱、石炭酸不是酸、双氧水不是水 | |
| C. | 电解质在水溶液中的反应都是离子反应 | |
| D. | 我国首创的新型抗疟疾药青蒿素(C15H22O5)属于氧化物 |
14.在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
| A. | Fe2+和 Fe3+ | B. | Fe2+ | C. | Cu2+ 和Fe2+ | D. | Cu2+ |
