题目内容
由第ⅡA族金属单质A和第ⅢA族金属单质B组成的混合物1.29g,用过量的盐酸其完全溶解后生成的氢气在标况下的体积为1.456L.若A和B的原子量之比为8:9,混合物中A和B的原子个数比为2:3,求A、B的相对原子质量.
考点:化学方程式的有关计算,相对原子质量及其计算
专题:计算题
分析:A、B两种金属元素的相对原子质量之比是8:9,设金属的相对原子质量分别为8x、9x,金属的化合价分别为+2、+3,由两种金属单质按物质的量之比为2:3组成混合物与足量酸反应放出氢气的量及氢气的体积相等来列式计算.
解答:
解:设金属的相对原子质量分别为8x、9x,金属的化合价分别为+2、+3,
A、B的物质的量为2y,3y,由题意可知,
①8x×2y+9x×3y=1.29,
②2y×2+3y×3=
×2×1,
解得x=3
当x=3时,金属A的相对原子质量为24,金属B的相对原子质量为27,;
答:A的相对原子质量为,B的相对原子质量为27g.
A、B的物质的量为2y,3y,由题意可知,
①8x×2y+9x×3y=1.29,
②2y×2+3y×3=
| 1.456L |
| 22.4L/mol |
解得x=3
当x=3时,金属A的相对原子质量为24,金属B的相对原子质量为27,;
答:A的相对原子质量为,B的相对原子质量为27g.
点评:本题考查金属与酸的反应,不需要书写化学反应方程式,学生利用质量关系、电子守恒来列式即可解答,题目难度不大,侧重分析能力及计算能力的考查.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列条件下,离子能大量共存或者离子方程式正确的是( )
| A、pH=1的溶液中:Fe2+、ClO-、Na+、SO42- |
| B、在含较多Al3+的溶液中:K+、Cl-、HCO3- |
| C、一小块钠投入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ |
| D、铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
下列既是氧化还原反应,又是吸热反应的是( )
| A、葡萄糖在人体内氧化 |
| B、锌粒与稀H2SO4反应制取H2 |
| C、Ba(OH)2?8H2O与NH4Cl反应 |
| D、二氧化碳与赤热的炭反应生成一氧化碳 |
 填写下列空白:
填写下列空白: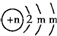 ,请回答下列问题:
,请回答下列问题: