题目内容
某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
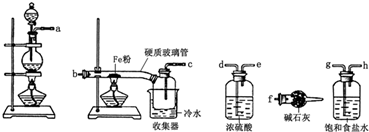
(1)装置的连接顺序为a→ → → → →b→c→f.
(2)硬质玻璃管中可观察到的现象是 .
硬质玻璃管与收集器之间没有用导管连接,原因是 .
反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
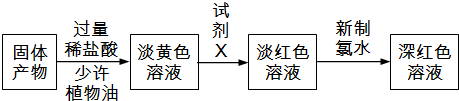
(3)试剂X的化学式为 ;有同学分析淡黄色溶液中含有Fe2+,你认为 (填“合理”或“不合理”);固体产物的成分可能为 (填相应的字母);
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是 ,用离子方程式表示加入新制氯水后溶液红色加深的原因: .
(5)某小组同学实验时在加入新制氯水后,并未得到深红色溶液,请帮助他们分析原因:
请设计实验对你所分析的原因进行验证,简要写出实验方案. .

(1)装置的连接顺序为a→
(2)硬质玻璃管中可观察到的现象是
硬质玻璃管与收集器之间没有用导管连接,原因是
反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

(3)试剂X的化学式为
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是
(5)某小组同学实验时在加入新制氯水后,并未得到深红色溶液,请帮助他们分析原因:
请设计实验对你所分析的原因进行验证,简要写出实验方案.
考点:探究物质的组成或测量物质的含量,铁及其化合物的性质实验,氯、溴、碘的性质实验
专题:实验设计题
分析:(1)排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理;
(2)Fe在氯气中燃烧生成棕褐色烟,导气管口较细,易堵塞;
(3)Fe3+用KSCN溶液检验,Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色;Fe和稀盐酸、氯化铁反应生成FeCl2;
(4)Fe2+不稳定而易被氧化;Fe2+被氯气氧化生成Fe3+,从而增大Fe3+浓度;
(5)Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,氯水具有强氧化性,能氧化还原性物质,如果Fe3+和KSCN混合溶液中加入氯水后未得到深红色溶液,说明溶液中硫氰化铁浓度未变大.
(2)Fe在氯气中燃烧生成棕褐色烟,导气管口较细,易堵塞;
(3)Fe3+用KSCN溶液检验,Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色;Fe和稀盐酸、氯化铁反应生成FeCl2;
(4)Fe2+不稳定而易被氧化;Fe2+被氯气氧化生成Fe3+,从而增大Fe3+浓度;
(5)Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,氯水具有强氧化性,能氧化还原性物质,如果Fe3+和KSCN混合溶液中加入氯水后未得到深红色溶液,说明溶液中硫氰化铁浓度未变大.
解答:
解:(1)浓硫酸具有吸水性能作氯气干燥剂、碱石灰具有碱性而吸收氯气、饱和食盐水吸收氯化氢而抑制氯气溶解,装置排列顺序为气体的制取→洗气→干燥→氯气和铁的反应→尾气处理,所以装置连接顺序为a→g→h→d→e→b→c→f,故答案为:g;h;d;e;
(2)Fe在氯气中燃烧生成棕褐色烟,所以看到的现象是有棕褐色烟生成;棕褐色烟冷却易生成固体,导气管口较细,易堵塞,所以硬质玻璃管与收集器之间没有用导管连接,
故答案为:有棕褐色烟生成;防止堵塞(或其他合理描述都可);
(3)Fe3+用KSCN溶液检验,Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,所以试剂X为KSCN溶液;固体和氯气反应时可能没有完全反应,导致Fe和稀盐酸、氯化铁反应生成氯化亚铁,Fe和稀盐酸反应生成FeCl2,所以分析合理,固体中成分为Fe和FeCl3,
故答案为:KSCN;合理;A;
(4)Fe2+不稳定,易被空气中氧气氧化,所以植物油的作用是隔绝空气防止Fe2+被氧化;Fe2+被氯气氧化生成Fe3+,从而增大Fe3+浓度,Fe3+、SCN-反应生成Fe(SCN)3,从而增大络合物浓度,溶液颜色加深,涉及的反应方程式为2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3,
故答案为:隔绝空气,防止Fe2+被氧化; 2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3;
(5)Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,氯水具有强氧化性,能氧化还原性物质,如果Fe3+和KSCN混合溶液中加入氯水后未得到深红色溶液,说明溶液中硫氰化铁浓度未变大,则可能原因是新制氯水将SCN-氧化;
其检验方法是:取少许褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则原因分析成立,
故答案为:新制氯水将SCN-氧化;取少许褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则原因分析成立.
(2)Fe在氯气中燃烧生成棕褐色烟,所以看到的现象是有棕褐色烟生成;棕褐色烟冷却易生成固体,导气管口较细,易堵塞,所以硬质玻璃管与收集器之间没有用导管连接,
故答案为:有棕褐色烟生成;防止堵塞(或其他合理描述都可);
(3)Fe3+用KSCN溶液检验,Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,所以试剂X为KSCN溶液;固体和氯气反应时可能没有完全反应,导致Fe和稀盐酸、氯化铁反应生成氯化亚铁,Fe和稀盐酸反应生成FeCl2,所以分析合理,固体中成分为Fe和FeCl3,
故答案为:KSCN;合理;A;
(4)Fe2+不稳定,易被空气中氧气氧化,所以植物油的作用是隔绝空气防止Fe2+被氧化;Fe2+被氯气氧化生成Fe3+,从而增大Fe3+浓度,Fe3+、SCN-反应生成Fe(SCN)3,从而增大络合物浓度,溶液颜色加深,涉及的反应方程式为2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3,
故答案为:隔绝空气,防止Fe2+被氧化; 2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3;
(5)Fe3+和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,氯水具有强氧化性,能氧化还原性物质,如果Fe3+和KSCN混合溶液中加入氯水后未得到深红色溶液,说明溶液中硫氰化铁浓度未变大,则可能原因是新制氯水将SCN-氧化;
其检验方法是:取少许褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则原因分析成立,
故答案为:新制氯水将SCN-氧化;取少许褪色后的溶液于试管中,再滴加几滴KSCN溶液,若溶液变红,则原因分析成立.
点评:本题以氯气的制取、氯气和铁的反应为载体考查物质成分测定、性质实验方案设计,为高考高频点,侧重考查元素化合物性质、离子检验等知识点,明确实验原理是解本题关键,难点是实验方案设计的实施,易错点是装置排列顺序,注意结合实验目的分析,题目难度中等.

练习册系列答案
相关题目
在xR2++yH++O2=mR3++nH2O的离子反应中,化学计量数m的值为( )
| A、2x | ||
| B、4 | ||
C、
| ||
| D、2 |
下列叙述正确的是( )
| A、1 mol H2O的质量为18 g?mol-1 |
| B、3.01×1023个SO2分子的质量为32 g |
| C、CH4的摩尔质量为16 g |
| D、1 mol任何物质均含有6.02×1023个分子 |
氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为( )
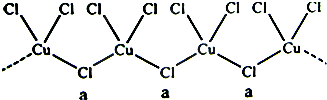

| A、sp杂化 |
| B、sp2杂化 |
| C、sp3杂化 |
| D、dsp2杂化 |
 (1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是
(1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是 氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)
 (Ⅰ) 在一个容积固定不变的密闭容器中进行反应:
(Ⅰ) 在一个容积固定不变的密闭容器中进行反应: