题目内容
自然界中氮元素有多种存在形式.
(1)合成氨反应的化学方程式是 .
(2)NH3在一定条件下可被氧化.
已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1269kJ/mol①断开1molH-O键与断开1molH-N键所需能量相差约 kJ.

②H-O键比H-N键(填“强”或“弱”) .
(1)合成氨反应的化学方程式是
(2)NH3在一定条件下可被氧化.
已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1269kJ/mol①断开1molH-O键与断开1molH-N键所需能量相差约

②H-O键比H-N键(填“强”或“弱”)
考点:热化学方程式,反应热和焓变
专题:化学反应中的能量变化
分析:(1)工业上利用氮气和氢气来合成氨;
(2)①根据物质的键能变化计算;
②根据键能的差值,判断键的强弱.
(2)①根据物质的键能变化计算;
②根据键能的差值,判断键的强弱.
解答:
解:(1)工业上利用氮气和氢气来合成氨,方程式为N2+3H2
2NH3,故答案为:N2+3H2
2NH3;
(2)①根据4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol,可知12H-N+3×498kJ/mol-2×946kJ/mol-12H-O=-1269kJ/mol,得(H-O)-(H-N)=72.6kJ/mol,故答案为:72.6;
②根据(H-O)-(H-N)=72.6kJ/mol,可知H-O 键比H-N键强,故答案为:强.
| ||
| 高温高压 |
| ||
| 高温高压 |
(2)①根据4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol,可知12H-N+3×498kJ/mol-2×946kJ/mol-12H-O=-1269kJ/mol,得(H-O)-(H-N)=72.6kJ/mol,故答案为:72.6;
②根据(H-O)-(H-N)=72.6kJ/mol,可知H-O 键比H-N键强,故答案为:强.
点评:本题是一道有关氮元素的综合题,考查学生分析和解决问题的能力,题目难度大.

练习册系列答案
相关题目
下列关于砷(As)元素的叙述中,正确的是( )
| A、在AsCl3分子中,砷原子最外层电子数为8 |
| B、Na3AsO4溶液的pH大于7 |
| C、砷的氢化物的化学式为AsH3,它是一种强氧化剂 |
| D、砷的相对原子质量为74.92,由此可知砷原子核内有42个中子 |
下列事实一定能证明HNO2是弱电解质的是( )
①常温下HNO2溶液的pH小于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol/L HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥pH=1的HNO2溶液稀释至100倍,pH约为2.8
⑦常温下NaNO2溶液的pH大于7.
①常温下HNO2溶液的pH小于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol/L HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥pH=1的HNO2溶液稀释至100倍,pH约为2.8
⑦常温下NaNO2溶液的pH大于7.
| A、①④⑥ | B、①②③④ |
| C、④⑤⑥⑦ | D、全部 |
用惰性电极电解硫酸铜溶液一段时间后,向溶液中加入1mol Cu(OH)2后恰好恢复到原来浓度,下列说法不正确的是( )
| A、阴极产物是Cu和H2 |
| B、阳极共产生11.2L的O2 |
| C、电解过程中溶液的PH值不断减小 |
| D、电解过程中电子转移数目4NA |
已知H2S两级电离常数分别为K1=1.3×10-7,K2=7.1×10-15;CH3COOH的电离常数K=1.75×10-5,试根据上述数据,判断下列化学反应方程式正确的是( )
| A、Na2S+2CH3COOH(足量)=2CH3COONa+H2S↑ |
| B、Na2S+2CH3COOH(少量)=2CH3COONa+H2S↑ |
| C、Na2S(少量)+CH3COOH=CH3COONa+NaHS |
| D、CH3COOH+NaHS=CH3COONa+H2S↑ |
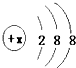 所示,该微粒氧化性甚弱,但得到电子后还原性强,且这种原子有一个单电子,这种微粒的符号是
所示,该微粒氧化性甚弱,但得到电子后还原性强,且这种原子有一个单电子,这种微粒的符号是