题目内容
19.等质量的下列物质与足量稀硝酸反应,放出NO物质的量最少的是( )| A. | FeO | B. | Fe2O3 | C. | FeSO4 | D. | Fe3O4 |
分析 假设质量都为mg,根据n=$\frac{m}{M}$计算各物质的物质的量,由电子转移守恒可知,失去电子物质的量越大生成NO越多.
解答 解:假设质量都为mg,
A.mgFeO与硝酸反应被氧化生成Fe3+,则失电子物质的量为$\frac{mg}{72g/mol}$×(3-2)=$\frac{m}{72}$mol;
B.Fe2O3与硝酸不发生氧化还原反应,失电子为0;
C.FeSO4与硝酸反应被氧化生成Fe3+,则失电子物质的量为$\frac{m}{152}$mol;
D.Fe3O4中Fe元素的化合价有+2、+3价,与硝酸反应被氧化生成Fe3+,则失电子物质的量为$\frac{mg}{232/mol}$×(9-3×$\frac{8}{3}$)=$\frac{m}{232}$mol,
由以上分析可知,失电子最多的是FeO,则放出NO物质的量最多的是FeO,
故选B.
点评 本题考查氧化还原反应的相关计算,注意把握Fe元素的化合价的变化,难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
9.下列分子中,具有极性共价键的非极性分子的是( )
| A. | l2 | B. | NH3(三角锥型) | C. | CO2 | D. | SO2(键角120°) |
10.下列有关说法不正确的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于苯环对侧链的影响,使侧链易被氧化 | |
| C. | 若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 | |
| D. | 菲的结构简式为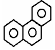 ,它与硝酸反应,可生成3种一硝基取代物 ,它与硝酸反应,可生成3种一硝基取代物 |
7.一定温度下,向1.0L密闭容器中加入0.60mol X(g),发生反应X(g)?Y(s)+2Z(g)△H>0,测得反应物X浓度与反应时间的数据如表:
反应开始至4min时用Z表示的平均反应速率v(Z)=0.225mol•L-1•min-1.
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 |
| c(X)/(mol•L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 |
11.下列说法中正确的是( )
| A. | 金属单质在化学反应中只能做还原剂 | |
| B. | 非金属单质在化学反应中只能做氧化剂 | |
| C. | 金属原子在化学反应中失去的电子越多,其还原性就越强 | |
| D. | 置换反应不一定是氧化还原反应 |
8.钠暴露在空气中,最终变成的物质是( )
| A. | 碳酸钠 | B. | 氢氧化钠 | C. | 氧化钠 | D. | 过氧化钠 |
12.下列叙述正确的是( )


| A. | 如图 1 所示,若铜中含有杂质银,可形成原电池,且铜作负极 | |
| B. | 如图 2 所示,当有 0.1 mol 电子转移时,有 0.1 mol Cu2O 生成 | |
| C. | 基于绿色化学理念设计的制取 Cu2O 的电解池如图 2 所示,铜电极发生还原反应 | |
| D. | 若图 3 所示的装置中发生 Cu+2Fe3+═Cu2++2Fe2+的反应,则 X 极是负极,Y 极的材料可 以是铜 |