题目内容
已知HA与HB均为弱酸,且HA的酸性比HB弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列正确的是( )
| A、c(HA)>c(HB) |
| B、c(A-)>c(B-) |
| C、c(H+)>c(OH-) |
| D、c(A-)+c(B-)>c(Na+) |
考点:离子浓度大小的比较
专题:
分析:在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,由于HA与HB均为弱酸,且HA的酸性比HB弱,A-水解程度比B-大,由于水解生成酸分子和氢氧根离子,所以在NaA和NaB混合溶液中,c(HA)>c(HB),c(A-)<c(B-),c(H+)<c(OH-),根据元素守恒,c(HA)+c(HB)+c(A-)+c(B-)=c(Na+),所以c(A-)+c(B-)<c(Na+),据此答题;
解答:
解:在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,由于HA与HB均为弱酸,且HA的酸性比HB弱,A-水解程度比B-大,由于水解生成酸分子和氢氧根离子,
A、由上面的分析可知,在NaA和NaB混合溶液中,c(HA)>c(HB),故A正确;
B、因为在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,c(A-)<c(B-),故B错误;
C、因为在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,c(H+)<c(OH-),故C错误;
D、根据元素守恒,c(HA)+c(HB)+c(A-)+c(B-)=c(Na+),所以c(A-)+c(B-)<c(Na+),故D错误;
故选A.
A、由上面的分析可知,在NaA和NaB混合溶液中,c(HA)>c(HB),故A正确;
B、因为在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,c(A-)<c(B-),故B错误;
C、因为在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,c(H+)<c(OH-),故C错误;
D、根据元素守恒,c(HA)+c(HB)+c(A-)+c(B-)=c(Na+),所以c(A-)+c(B-)<c(Na+),故D错误;
故选A.
点评:本题主要考查了盐类的水解,根据水解程度不同,判断离子浓度大小,难度不大,解题时要注意运用盐类水解中越弱越水解的原理.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
一定质量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量是( )
| A、4.4g |
| B、1.4g |
| C、2.2g |
| D、在2.2g和4.4g之间 |
欲配制100mL1.0mol/LNa2CO3溶液,正确的方法是( )
| A、将10.6gNa2CO3溶于100mL水中 |
| B、将28.6g Na2CO3?10H2O溶于少量水中,再用水稀释至100mL |
| C、将20mL5.0mol/L Na2CO3溶液用水稀释至100mL |
| D、在20mL5.0mol/L Na2CO3溶液中加入80mL水 |
家用保鲜膜上表有PE,PE是指( )
| A、聚乙烯塑料 |
| B、聚丙烯塑料 |
| C、聚苯乙烯塑料 |
| D、聚氯乙烯塑料 |
下列实验的相关描述正确的是( )


| A、快速分离氢氧化铁胶状沉淀和氯化钠溶液可用抽滤法 |
| B、常温下,苯酚与水形成的浊液静置后会分层,上层为溶有水的苯酚溶液 |
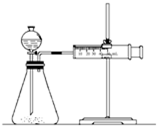
| C、甲装置可用于某些化学反应速率的测定.该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处 |
| D、乙装置可用来制取和检验二氧化硫气体漂白性,待滤纸颜色褪去后立即用浸有碱液的棉花堵住试管口 |
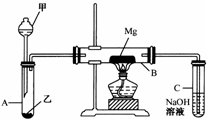 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.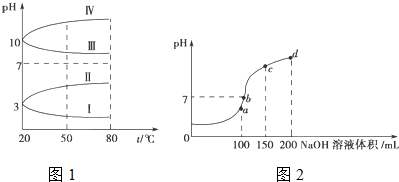
 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.