题目内容
8.已知1g乙醇(C2H5OH)完全燃烧生成CO2气体和液态水时,放出29.7kJ的热量,写出乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ/mol.分析 表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物,依据1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,结合燃烧热的定义计算求出1mol乙醇完全燃烧放出的热量,然后写出热化学方程式.
解答 解:燃烧热是指:在25℃、101KPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,则1mol乙醇的质量为46g,完全燃烧生成稳定的氧化物放出的热量为46×29.7kJ=1366.2kJ,
其燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1,
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比;同时还考查了反应热的计算,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列应用不涉及氧化还原反应的是( )
| A. | 铝热反应 | B. | 工业炼铁 | ||
| C. | Na2O2用于呼吸面具中 | D. | 实验室制氨气 |
19.下列说法正确的是( )
| A. | Ag是短周期元素 | |
| B. | 主族元素的最高价都等于其最外层电子数 | |
| C. | Ne元素属于零族元素 | |
| D. | N的氢化物为H3N |
3.现有0.1mol某金属单质与足量的硫酸溶液反应,放出1.12LH2(标准状况),并转变为具有Ne原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
13. “即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
“即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
 “即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
“即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )| A. | 氢氧化钡晶体和氯化铵晶体 | B. | 生石灰与水 | ||
| C. | 金属钠与水 | D. | 氯化钠与水 |
20.草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)该反应中氧化剂是MnO4-.(填化学式)
(2)对比实验Ⅰ和Ⅱ(用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验Ⅰ和Ⅲ.
(3)对比实验Ⅰ和Ⅳ,可以研究浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同.
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其它物质 |
| Ⅰ | 2mL | 20 | / |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | / |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验Ⅰ和Ⅱ(用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验Ⅰ和Ⅲ.
(3)对比实验Ⅰ和Ⅳ,可以研究浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同.
17.下列说法中正确的是( )
| A. | HF、HCl、H2S、PH3的稳定性依次增强 | |||||||||||||||
| B. | 按Mg、Si、N、F的顺序,原子半径由小变大 | |||||||||||||||
| C. | 某主族元素的电离能I1~I7数据如表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族
| |||||||||||||||
| D. | 在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41 |
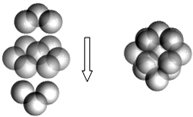 黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:
黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物.室温为非活性物质.温度升高后变得活泼.在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸: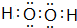 ,B的最高价氧化物的结构式:O=C=O.用电子式表示EF的形成过程
,B的最高价氧化物的结构式:O=C=O.用电子式表示EF的形成过程 .
.