题目内容
3.现有0.1mol某金属单质与足量的硫酸溶液反应,放出1.12LH2(标准状况),并转变为具有Ne原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
分析 0.1mol某金属单质与足量的硫酸溶液反应,放出1.12LH2(标准状况),设金属元素在化合物中的化合价为x,由电子守恒可知0.1mol×(x-0)=$\frac{1.12L}{22.4L/mol}$×2×(1-0),解得x=1,并转变为具有Ne原子的电子层结构的离子,则质子数为10+1=11,即为Na,以此来解答.
解答 解:0.1mol某金属单质与足量的硫酸溶液反应,放出1.12LH2(标准状况),设金属元素在化合物中的化合价为x,由电子守恒可知0.1mol×(x-0)=$\frac{1.12L}{22.4L/mol}$×2×(1-0),解得x=1,并转变为具有Ne原子的电子层结构的离子,则质子数为10+1=11,即为Na,Na位于第三周期第IA族,
故选A.
点评 本题考查元素周期表结构及应用,为高频考点,把握电子守恒计算元素的化合价为解答的关键,注意失去电子后为10电子离子,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
13.非金属元素除稀有气体元素外,共有16种.下列对这16种非金属元素的叙述中正确的是( )
| A. | 都是主族元素 | |
| B. | 最外层电子数都大于或等于4 | |
| C. | 单质在反应中都只能作氧化剂 | |
| D. | 氧化物常温下都可以与水反应生成酸 |
14.下列物质中,有共价键的化合物是( )
| A. | N2 | B. | CH4 | C. | NaCl | D. | MgCl2 |
11.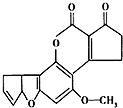 黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( )
黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( )
 黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( )
黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( )| A. | 6mol,2mol | B. | 7mol,2mol | C. | 6mol,1mol | D. | 7mol,1mol |
18.下列化学用语正确的是( )
| A. | 氯化钠的电子式: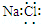 | |
| B. | 聚乙烯的结构简式: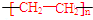 | |
| C. | 硫离子的结构示意图: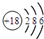 | |
| D. | 碳酸氢铵的电离方程式:NH4HCO3=NH4++H++CO32ˉ |
15.对与反应2HI(g)?H2(g)+I2(g紫色),下列叙述能够说明已达平衡状态的是( )
| A. | 温度和体积一定时,容器内压强不再变化 | |
| B. | 生成H2和生成HI的速率相等 | |
| C. | 混合气体的颜色不再变化 | |
| D. | 各物质的物质的量浓度之比为2:1:1 |
13.下列变化中,不需要破坏化学键的是( )
| A. | 碘升华 | B. | 加热氯酸钾使其分解 | ||
| C. | 氯化氢溶于水 | D. | 氯化钠溶于水 |
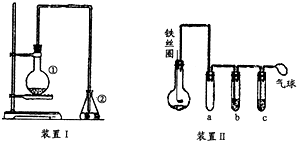 为探究苯与溴的取代反应,甲同学用如图所示的装置Ⅰ进行实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
为探究苯与溴的取代反应,甲同学用如图所示的装置Ⅰ进行实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应. .
. 与Br2,要想得到纯净的产物,可用NaOH溶液试剂.洗涤后分离粗产吕应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液试剂.洗涤后分离粗产吕应使用的仪器是分液漏斗.