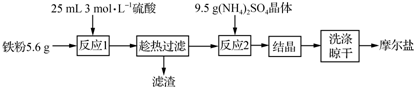
题目内容
8.下列分子中,既含有极性键又含有非极性键而且是非极性分子的是( )| A. | CO2 | B. | CH4 | C. | C2H4 | D. | C2H5Cl |
分析 非极性共价键为同种非金属元素的原子间形成共价键;极性共价键是由不同种非金属元素的原子间易形成的共价键;由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子,据此进行判断.
解答 解:A.CO2为极性键形成的非极性分子,不存在非极性键,故A错误;
B.CH4分子中只存在极性键,不存在非极性键,故B错误;
C.C2H4中含有极性键和非极性键,是平面型分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故C正确;
D.C2H5Cl分子中含有极性键和非极性键,但是其结构不对称,为极性分子,故D错误;
故选C.
点评 本题考查了分子极性、键的极性的判断,题目难度不大,明确极性键与非极性键、极性分子与非极性分子的区别为解答关键,注意掌握键的极性、分子极性的判断方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
19.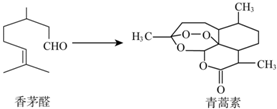 中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
 中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )| A. | 香茅醛能使Br2的CCl4溶液褪色 | B. | 青蒿素分子式为C15H22O5 | ||
| C. | 青蒿素含有和H2O2相同的过氧键 | D. | 青蒿素能与氢气发生加成反应 |
16.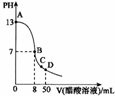 常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )
常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )
 常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )
常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )| A. | 曲线上任一点:c(Na+)+c(H+)=c(0H-)+c(CH3C00H) | |
| B. | 在 B点,a=25,且有 c(Na+)=c(CH3C00-)>c(0H-)=c(H+) | |
| C. | 在C点:c(Na+)>c(CH3C00-)>c(H+)>c(0H-) | |
| D. | 在D点:c(CH3C00-)+c(CH3C00H)=2c(Na+) |
13.在厨房里对水进行下列操作,能促进水的电离的是( )
| A. | 加入少量酒精 | B. | 加入少量食醋 | ||
| C. | 把水放入冰箱中使其降温至1℃ | D. | 把水加热至沸腾 |
20.下列关于元素周期表的说法正确的是( )
| A. | 过渡元素全部都是副族元素 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共七个横行代表七个周期,18个纵行代表18个族 | |
| D. | 主族元素原子的最外层电子数等于该元素所属的族序数 |
18.X、Y、Z、W均为短周期元素,他们在元素周期表的位置如图所示.若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |