��Ŀ����
3����1����������Ҫ�ĵ��ʣ��Dz������Ļ�����Ʒ֮һ����ϳ�ԭ��Ϊ��N2��g��+3H2��g�� 2NH3��g����H=-92.4kJ•mol-1����
�ڶ���2���ܱ������У�ʹ2mol N2��6mol H2��Ϸ�����Ӧ��ƽ��ʱN2ת����Ϊ20%��
����Ӧ�ﵽƽ��ʱ��H2��Ũ����2.4mol/L
��2��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽���÷�Ӧԭ������������ʵ�飺���ݻ�Ϊ1L���ܱ������У�����1molCO2��3molH2����500���·�����Ӧ��
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
ʵ����CO2��CH3OH��g�������ʵ�����n����ʱ��仯��ͼ1��ʾ��
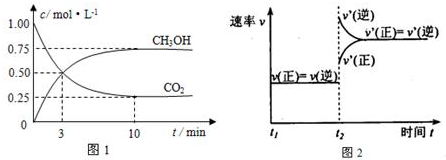
�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2��=0.225mol/��L•min��
500���ƽ��ʱ��CH3OH��g�����������Ϊ30%��
���� ��1��ʹ2mol N2��6mol H2��Ϸ�����Ӧ��ƽ��ʱN2ת����Ϊ20%����֪�μӷ�Ӧ�ĵ���Ϊ2mol��20%=0.4mol����Ϸ�Ӧ��֪�μӷ�Ӧ������Ϊ0.4mol��3=1.2mol�����c=$\frac{n}{V}$����ﵽƽ��ʱH2��Ũ�ȣ�
��2�����ݻ�Ϊ1L���ܱ������У�����1molCO2��3molH2����ͼ��֪10min�ﵽƽ��ʱc��CH3OH��=0.75mol/L����
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ 1 3 0 0
ת�� 0.75 2.25 0.75 0.75
ƽ�� 0.25 0.75 0.75 0.75
���v=$\frac{��c}{��t}$�����ʵ����ȵ�������ȼ��㣮
��� �⣺��1��ʹ2mol N2��6mol H2��Ϸ�����Ӧ��ƽ��ʱN2ת����Ϊ20%����֪�μӷ�Ӧ�ĵ���Ϊ2mol��20%=0.4mol����Ϸ�Ӧ��֪�μӷ�Ӧ������Ϊ0.4mol��3=1.2mol����Ӧ�ﵽƽ��ʱ��H2��Ũ����$\frac{6mol-1.2mol}{2L}$=2.4mol/L��
�ʴ�Ϊ��2.4mol/L��
��2�����ݻ�Ϊ1L���ܱ������У�����1molCO2��3molH2����ͼ��֪10min�ﵽƽ��ʱc��CH3OH��=0.75mol/L����
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ 1 3 0 0
ת�� 0.75 2.25 0.75 0.75
ƽ�� 0.25 0.75 0.75 0.75
�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2��=$\frac{2.25mol/L}{10min}$=0.225mol/��L•min����
500���ƽ��ʱ��CH3OH��g�����������Ϊ$\frac{0.75}{0.25+0.75+0.75+0.75}$��100%=30%��
�ʴ�Ϊ��0.225mol/��L•min����30%��
���� ���⿼�黯ѧƽ����㣬Ϊ��Ƶ���㣬����ͼ��Ũ�ȵı仯�����ʼ���������ļ���Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��ƽ�����η���Ӧ�ã���Ŀ�ѶȲ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д���1����ҵ������ˮú���ϳɶ����ѵ�������Ӧ���£�
��2H2��g��+CO��g��???CH3OH��g����H=a kJ•mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g����H=b kJ•mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g����H=c kJ•mol-1
���ڲ����¹��յ��ܷ�ӦΪ3CO��g��+3H2��g��?CH3OCH3��g��+CO2��g�����÷�Ӧ�ġ�H=��2a+b+c��kJ•mol-1��ƽ�ⳣ������ʽK=$\frac{c��C{H}_{3}OC{H}_{3}��c��C{O}_{2}��}{{c}^{3}��CO��{c}^{3}��{H}_{2}��}$��
��2������ѹǿ��CH3OCH3�IJ��������������С�����䡱����
��3��ԭ�����з�Ӧ�ٺͷ�Ӧ�ڷֱ��ڲ�ͬ�ķ�Ӧ���н��У���Ӧ�۷������¹����з�Ӧ�۵ķ��������CH3OCH3�IJ��ʣ�ԭ���Ƿ�Ӧ�������˷�Ӧ���еIJ���H2O��ʹ��Ӧ�ڵĻ�ѧƽ��������Ӧ�����ƶ����Ӷ����CH3OCH3�IJ��ʣ�
��4��Ϊ��Ѱ�Һ��ʵķ�Ӧ�¶ȣ��о��߽�����һϵ��ʵ�飬ÿ��ʵ�鱣��ԭ��������ɡ�ѹǿ����Ӧʱ������ز��䣬ʵ������ͼ��COת�������¶ȱ仯�Ĺ������¶ȵ���240��ʱ��CO��ת���������¶ȵ����߶������¶ȸ���240��ʱ��CO��ת���������¶ȵ����߶���С����ԭ�����ڽϵ���ʱ������Ӧ��ϵ��δ�ﵽƽ�⣬CO��ת������Ҫ�ܷ�Ӧ����Ӱ�죬�����¶ȵ����߷�Ӧ��������CO��ת����Ҳ�����ڽϸ���ʱ������Ӧ��ϵ���Ѵﵽƽ�⣬CO��ת������Ҫ�ܷ�Ӧ��Ӱ�죬�����¶ȵ�����ƽ�����淴Ӧ�����ƶ���CO��ת���ʼ�С����

��5����֪��Ӧ��2CH3OH��g��?CH3OCH3��g��+H2O��g��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/mol•L-1 | 0.64 | 0.50 | 0.50 |
������ʼֻ����CH3OH����10min��Ӧ�ﵽƽ�⣬ƽ��ʱCH3OH��ת���ʦ���CH3OH��=97.5%��
| �� ���� | I A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J | K |
��2������������ˮ���������ǿ����KOH��������ǿ����HClO4�������Ե���Al��OH��3��
��3��A�ֱ���D��E��F��G��H�γɵĻ������У����ȶ���HF��
��4������ЩԪ���У���I�⣩��ԭ�Ӱ뾶������K��ԭ�Ӱ뾶��С����F
��5��D��K��ɻ�����ĵ���ʽ
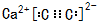 ��
����6��B������������ˮ�����C��������������Ӧ�����ӷ���ʽ��Al2O3+2OH-=2AlO2-+2H2O��
| A�� | ��ѧ�仯һ�����������仯 | |
| B�� | ��ѧ�仯һ���л�ѧ���Ķ��Ѻ����� | |
| C�� | ��ѧ�仯һ���������ʵ�״̬�仯 | |
| D�� | ��ѧ�仯һ�������������� |
| A�� | ��� | B�� | ��Ƿ� | C�� | ̿�� | D�� | ��ľ�� |
 ij����ֻ��C��H��O����Ԫ�أ������ģ����ͼ��ʾ�������й���12��ԭ�ӣ�ͼ��������֮������ߴ���������˫���Ȼ�ѧ������
ij����ֻ��C��H��O����Ԫ�أ������ģ����ͼ��ʾ�������й���12��ԭ�ӣ�ͼ��������֮������ߴ���������˫���Ȼ�ѧ������