题目内容
下列关于杂化轨道的叙述中,不正确的是( )
| A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B、杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子 |
| C、杂化轨道理论与价层电子互斥理论都可以分析分子的空间构型 |
| D、[Cu(NH3)4]2+和CH4两个微粒中中心原子Cu和C都是通过sp3杂化轨道成键 |
考点:原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构,可能是三角锥形或V形;
B、杂化轨道不能用于形成π键,只用于形成σ键或用于容纳未参与成键的孤对电子;
C、杂化轨道理论与价层电子互斥理论均用于分析判断分子的空间构型,且两种理论相互补充;
D、在[Cu(NH3)4]2+中Cu原子提供提供空轨道接受孤对电子形成配位键.
B、杂化轨道不能用于形成π键,只用于形成σ键或用于容纳未参与成键的孤对电子;
C、杂化轨道理论与价层电子互斥理论均用于分析判断分子的空间构型,且两种理论相互补充;
D、在[Cu(NH3)4]2+中Cu原子提供提供空轨道接受孤对电子形成配位键.
解答:
解:A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构,可能是三角锥形或V形,如NH3是三角锥形、H2O是V形,故A正确;
B、杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键,故B正确;
C、杂化轨道理论与价层电子互斥理论均用于分析判断分子的空间构型,且两种理论相互补充,故C正确;
D、在[Cu(NH3)4]2+中Cu原子提供提供空轨道接受孤对电子形成配位键,不是sp3杂化,故D错误.
故选:D.
B、杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键,故B正确;
C、杂化轨道理论与价层电子互斥理论均用于分析判断分子的空间构型,且两种理论相互补充,故C正确;
D、在[Cu(NH3)4]2+中Cu原子提供提供空轨道接受孤对电子形成配位键,不是sp3杂化,故D错误.
故选:D.
点评:本题考查杂化轨道和杂化理解,侧重分子结构与性质的考查,注意杂化轨道理论的理解,把握常见分子中原子的杂化及空间构型为解答的关键,题目难度中等.

练习册系列答案
相关题目
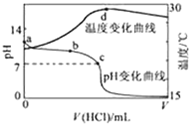 室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A、a点由水电离出的c(H+)=1.0×10-14mol/L |
| B、a、b之间可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
| C、c点:c(Cl-)═c(NH4+) |
| D、d点后,溶液温度略下降的主要原因是NH3?H2O电离吸热 |
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成.已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成.下列结论不正确的是( )
| A、甲溶液含有Ba2+ |
| B、乙溶液含有SO42- |
| C、丙溶液含有NH4+ |
| D、丁溶液含有HCO3- |
已知一定条件下二氧化碳气体的溶解平衡CO2(g)?CO2(aq)△H=-19.75kJ/mol,为增大CO2气体在水中的溶解度,下列方法一定可行的是( )
| A、升温增压 | B、降温减压 |
| C、升温减压 | D、降温增压 |
下列说法一定正确的是( )
A、 1,3,4-三甲苯 1,3,4-三甲苯 |
| B、Na2CO3?10H2O 石碱 |
| C、C3H6 丙烯 |
D、 硫化氢 硫化氢 |
原子总数相同,各原子的外层电子数之和也相同的粒子,互称等电子体.等电子体的结构相似、物理性质相近.下列各组粒子不能互称为等电子体的是( )
| A、14CO和14N2 |
| B、O3和SO2 |
| C、CO2和N2O |
| D、N2H4和C2H4 |
水是最宝贵的资源之一.下列表述正确的是( )
A、H2O的电子式为 |
| B、4℃时,纯水的pH=7 |
| C、D216O中,质量数之和是质子数之和的两倍 |
| D、水分子在三种状态中,分子间的平均距离d:d(气态)>d(液态)>d(固态) |