题目内容
1.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O=4Al(OH)3,下列说法错误的是( )| A. | 负极是铝失电子被氧化 | |
| B. | 电池工作时,电流由铝电极沿导线流向铂电极 | |
| C. | 以网状的铂为正极,可增大与氧气的接触面积 | |
| D. | 该电池通常只需更换铝板就可继续使用 |
分析 根据电池总反应可知,电池工作时,负极为Al,发生氧化反应,电极反应式为Al-3e-+3OH-=Al(OH)3,正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,结合原电池的工作原理解答该题.
解答 解:A.铝失电子作负极,被氧化,故A正确;
B.电池工作时,电流由正极流向负极,即从铂电极沿导线流向铝电极,故B错误;
C.铂做成网状的目的是增大与氧气的接触面积,故C正确;
D.Al不断反应,不断溶解,所以一段时间后,更换铝板就可以继续使用,故D正确.
故选B.
点评 本题考查化学电源知识,题目难度中等,注意原电池的两极上的变化以及原电池原理,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列化学式、电子式、结构式表示正确的是( )
| A. |  | B. |  | ||
| C. | 氨水化学式:NH4OH | D. | NH3结构式: |
12.下列对化学用语的理解正确的是( )
| A. | 原子结构示意图  ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 次氯酸的电子式  | |
| D. | CO2的比例模型: |
9.V L浓度为1.000 mol•L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
| A. | 向原溶液中通入常温常压下的HCl气体22.4V L,使其完全溶解 | |
| B. | 将溶液加热浓缩到0.5V L | |
| C. | 向原溶液中加入10.00 mol•L-1的盐酸0.2V L,再稀释至1.5V L | |
| D. | 向原溶液中加入V L 3 mol•L-1的盐酸混合均匀 |
16.铯137是金属铯的同位素之一,与“铀235”同属于放射性物质.下列对${\;}_{55}^{137}$Cs与${\;}_{92}^{235}$U描述正确的是( )
| A. | Cs与U的质子数差值为37 | B. | Cs与U的中子数差值为98 | ||
| C. | 铯137的电子数是82 | D. | 铀元素的相对原子质量是235 |
6.硝酸工业尾气中含有NO和NO2的混合物,可用纯碱溶液吸收,有关的化学反应为:
NO+NO2+Na2CO3=2NaNO2+CO2 ①
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ②
现用足量的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g.则吸收液中和NaNO2和NaNO3物质的量之比为( )
NO+NO2+Na2CO3=2NaNO2+CO2 ①
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ②
现用足量的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g.则吸收液中和NaNO2和NaNO3物质的量之比为( )
| A. | 5:3 | B. | 3:1 | C. | 1:1 | D. | 2:3 |
13.有机化学中取代反应范畴很广,下列4个反应中,属于取代反应范畴的是( )
| A. | 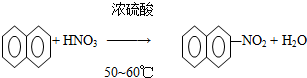 | |
| B. | 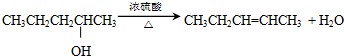 | |
| C. | CH3CHO+H2$→_{催化剂}^{高温高压}$CH3CH2OH | |
| D. | (CH3)2CHCH=CH2+HI→(CH3)2CHCHICH3+(CH3)2CHCH2CH2 I |
10.下列物质的电子式书写正确的是( )
| A. |  | B. |  | C. | Cl:Cl | D. | Na+[F]- |
