题目内容
2.已知25℃时,Ksp(Ag2S)=6.3×10-50、Ksp(AgI)=1.5×10-16,Ag2S难溶于水和稀盐酸,可溶于硝酸,其反应方程式为Ag2S+4HNO3=2AgNO3+2NO2↑+S↓+2H2O,下列说法正确的是( )| A. | 该反应中氧化剂与氧化产物的物质的量之比为4:1 | |
| B. | 生成3.2g S同时放出4.48LNO2 | |
| C. | AgI的悬浊液中滴加Na2S溶液可转化成黑色沉淀 | |
| D. | 若将产物NO2收集于密闭容器里再置于热水中,气体颜色变浅 |
分析 Ag2S+4HNO3=2AgNO3+2NO2↑+S↓+2H2O中,Ag元素的化合价不变,S的化合价从-2价升高到了0价,N元素的化合价从+5价降低到了+4价,根据化合价升降值=转移电子数,沉淀向着Ksp更小的物质转化,结合氧化还原反应中的概念知识以及平衡移动原理来回答判断.
解答 解:A、Ag2S+4HNO3=2AgNO3+2NO2↑+S↓+2H2O中,Ag元素的化合价不变,S的化合价从-2价升高到了0价,所以Ag2S是还原剂,S是氧化产物,N元素的化合价从+5价降低到了+4价,所以硝酸部分做氧化剂,氧化剂与氧化产物的物质的量之比为2:1,故A错误;
B、反应Ag2S+4HNO3=2AgNO3+2NO2↑+S↓+2H2O中,生成1molS同时放出2molNO2,所以生成3.2g即0.1molS同时放出0.2mol即标况下4.48LNO2,故B错误;
C、沉淀向着Ksp更小的物质转化,Ksp(Ag2S)=6.3×10-50<Ksp(AgI)=1.5×10-16,AgI的悬浊液中滴加Na2S溶液可转化成黑色沉淀Ag2S,故C正确;
D、2NO2(g)?N2O4(g)△H<0,若将产物NO2收集于密闭容器里再置于热水中,平衡逆向移动,所以气体颜色变深,故D错误.
故选C.
点评 本题考查学生氧化还原反应中的概念、沉淀转化、化学平衡移动原理等知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
12.如图所示各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )


| A. | (3)>(1)>(2)>(4) | B. | (2)>(1)>(3)>(4) | C. | (4)>(2)>(3)>(1) | D. | (4)>(2)>(1)>(3) |
17.下列相关反应的离子方程式书写正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO22ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | Na2S溶液显碱性:S2-+2H2O?H2S+2OH- | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
14.下列实验操作与安全事故处理错误的是( )
| A. | 在气体发生装置上直接点燃甲烷气体必须先检验甲烷的纯度 | |
| B. | 制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中 | |
| C. | 给试管中的液体加热,不时移动试管或加人碎瓷片,以免液体暴沸伤人 | |
| D. | 实验时不慎打破温度计水银球,应立即用滴管将水银吸出,放如水封的小瓶中,残破的温度计插人装有硫粉的广口瓶中 |
8.下列各组元素的原子序数中,其相应的元素原子能形成X2Y共价化合物的是( )
| A. | 11与16 | B. | 1与8 | C. | 12与17 | D. | 6与8 |
 (或
(或
 ).
).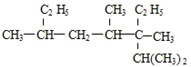 2,3,4,6-四甲基-3-乙基辛烷
2,3,4,6-四甲基-3-乙基辛烷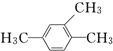 1,2,4-三甲苯
1,2,4-三甲苯