题目内容
7.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3.H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A.0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合得到等浓度CH3COOH和NaCl的混合溶液,醋酸是弱酸存在微弱电离;
B.0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合,pH>7,说明一水合氨电离程度大于铵根离子水解:
C.0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合,溶液中存在物料守恒,2n(Na)=3n(c);
D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,恰好发生反应醋酸钠溶液,溶液中存在质子守恒,氢氧根离子浓度等于所有氢离子存在形式总和.
解答 解:A.0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合得到等浓度CH3COOH和NaCl的混合溶液,醋酸是弱酸存在微弱电离,c(Na+)=c(Cl-)>c(CH3COO-)>c(H+)>c(OH-),故A错误;
B.0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合,pH>7,说明一水合氨电离程度大于铵根离子水解:c(NH4+)>c(Cl-)>c(NH3.H2O)>c(OH-),故B错误;
C.0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合,溶液中存在物料守恒,2n(Na)=3n(c),2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),故C正确;
D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,恰好发生反应醋酸钠溶液,溶液中存在质子守恒,氢氧根离子浓度等于所有氢离子存在形式总和,c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选C.
点评 本题考查了电解质溶液中离子浓度大小,酸碱反应生成溶液酸碱性判断,盐类水解、电荷守恒、物料守恒、质子守恒等知识点,题目难度中等.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案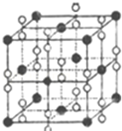 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)溴的价电子排布式为4s24p5;PCl3的空间构型为三角锥形
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为sp2杂化,写出CO的等电子体的微粒N2(写出1个).
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为CaO2.已知该氧化物的密度是ρg•cm-3,则晶胞离得最近的两个钙离子间的距离为$\frac{\sqrt{2}}{2}×\root{3}{\frac{4×72}{ρ{N}_{A}}}$cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
 .下列关于靛蓝的叙述中错误的是( )
.下列关于靛蓝的叙述中错误的是( )| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质属于烃 | D. | 它是不饱和的有机物 |
| A. |  | B. |  | C. |  | D. |  |

| A. | (3)>(1)>(2)>(4) | B. | (2)>(1)>(3)>(4) | C. | (4)>(2)>(3)>(1) | D. | (4)>(2)>(1)>(3) |
| A. | 甲苯 | B. | 苯 | C. | 2-丁炔 | D. | 聚乙烯 |
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO22ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | Na2S溶液显碱性:S2-+2H2O?H2S+2OH- | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
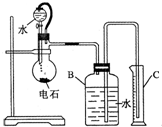 某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.
某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.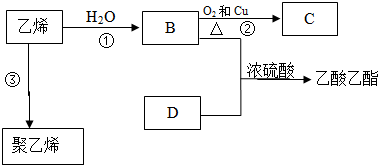
 .
. ,反应类型:加聚反应.
,反应类型:加聚反应. 