题目内容
下列叙述正确的是( )
| A、标准状况下,1.12L 16O2和1.12L 18O2均含有0.1NA个氧原子 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl-、NO3- |
| D、从C(石墨)═C(金刚石);△H=+1.9kJ?mol-1,可知金刚石比石墨更稳定 |
考点:阿伏加德罗常数,元素周期律的作用,反应热和焓变,离子共存问题
专题:基本概念与基本理论
分析:A.标况下1.12L气体的物质的量为0.05mol,16O2和18O2分子中都含有2个氧原子;
B.应该为最高价氧化物对应的水化物的酸性从左到右依次增强;
C.能使甲基橙显红色的溶液为酸性溶液,硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子;
D.物质能量越高,稳定性越差,该反应为吸热反应,石墨能量小于金刚石.
B.应该为最高价氧化物对应的水化物的酸性从左到右依次增强;
C.能使甲基橙显红色的溶液为酸性溶液,硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子;
D.物质能量越高,稳定性越差,该反应为吸热反应,石墨能量小于金刚石.
解答:
解:A.标准状况下1.12L氧气的物质的量为0.05mol,0.05mol16O2和1.12L 18O2均含有0.1mol氧原子,含有0.1NA个氧原子,故A正确;
B.第三周期非金属元素最高价含氧酸的酸性从左到右依次增强,没有指出元素的化合价为最高价,故B错误;
C.能使甲基橙显红色的溶液中中存在大量氢离子,NO3-在氢离子存在条件下能够氧化Fe2+,在溶液中不能大量共存,故C错误;
D.从C(石墨)═C(金刚石);△H=+1.9kJ?mol-1,石墨的能量低于金刚石,则石墨的稳定性高于金刚石,故D错误;
故选A.
B.第三周期非金属元素最高价含氧酸的酸性从左到右依次增强,没有指出元素的化合价为最高价,故B错误;
C.能使甲基橙显红色的溶液中中存在大量氢离子,NO3-在氢离子存在条件下能够氧化Fe2+,在溶液中不能大量共存,故C错误;
D.从C(石墨)═C(金刚石);△H=+1.9kJ?mol-1,石墨的能量低于金刚石,则石墨的稳定性高于金刚石,故D错误;
故选A.
点评:本题考查阿伏加德罗常数、离子共存、物质稳定性与能量的关系,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确离子共存的条件及物质能量越低、稳定性越强.

练习册系列答案
相关题目
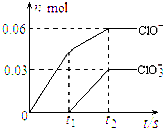 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、反应中转移电子的物质的量是0.21mol |
| B、ClO3-的生成是由于温度升高引起的 |
| C、苛性钾溶液中KOH的质量是16.8g |
| D、氯气被还原成0.06molClO-和0.03molClO3- |
白钨矿(主要成分为CaWO4)是一种重要的含钨矿物,CaWO4中钨元素(W)的化合价是( )
| A、+6 | B、+4 | C、+2 | D、-2 |
向三份0.1mol?L-1CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、NaCl固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
| A、减小、增大、减小 |
| B、增大、减小、不变 |
| C、减小、增大、不变 |
| D、增大、减小、增大 |
关于如图各实验装置的叙述正确的是( )

| A、装置甲可用于蒸干NH4Cl饱和溶液制备NH4Cl |
| B、装置乙可用于实验室制备少量氢气、氯气等 |
| C、装置丙可用于实验室检验麦芽糖中是否含有醛基 |
| D、装置丁可用于实验室干燥并收集氨气,同时进行尾气处理,防止污染大气 |
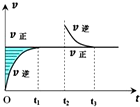 某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )
某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )| A、Z和W在该条件下一定不为气态 |
| B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C、若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等 |
| D、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
下列叙述不正确的是( )
| A、白铁(镀锌铁)镀层破损后,先被腐蚀的是铁 |
| B、锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率 |
| C、钢铁表面常易锈蚀生成Fe2O3?nH2O |
| D、金属的腐蚀主要是电化学腐蚀 |
判断食物的酸碱性,是根据食物进入人体后所生成的最终代谢物的酸碱性而定.含氮、磷等非金属元素较多食物,为酸性食物;含钠、钾、钙、镁等金属元素食物较多,为碱性食物.对食物的酸、碱性判断正确的是
( )
( )
| A、苹果是酸性食物 |
| B、猪肉、牛肉是碱性食物 |
| C、大米、面包是碱性食物 |
| D、巧克力、奶油是酸性食物 |