题目内容
下列有关离子方程式书写正确的( )
| A、在强碱溶液中次氯酸钠与Fe(0H)3反应生成Na2FeO4:3ClO-+2Fe(0H)3=2FeO42-+3Cl-+H2O+4H+ |
| B、从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| C、以金属银为阳极电解饱和硫酸铜溶液:Cu2++2 H2O=2Cu+O2 ↑+4H+ |
| D、过氧化氢能使酸性KMnO4溶液褪色:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.强碱溶液不能生成大量的氢离子;
B.酸性溶液中生成水;
C.金属银为阳极,阳极Ag失去电子;
D.发生氧化还原反应生成锰离子、氧气和水.
B.酸性溶液中生成水;
C.金属银为阳极,阳极Ag失去电子;
D.发生氧化还原反应生成锰离子、氧气和水.
解答:
解:A.在强碱溶液中次氯酸钠与Fe(0H)3反应生成Na2FeO4的离子反应为4OH-+3ClO-+2Fe(0H)3=2FeO42-+3Cl-+5H2O,故A错误;
B.从酸化的海带灰浸出液中提取碘的离子反应为:2I-+H2O2+2H+=I2+2H2O,故B错误;
C.以金属银为阳极电解饱和硫酸铜溶液,阳极反应为Ag-e-=Ag+,阴极反应为Cu2++2e-=Cu,故C错误;
D.过氧化氢能使酸性KMnO4溶液褪色的离子反应为5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O,故D正确;
故选D.
B.从酸化的海带灰浸出液中提取碘的离子反应为:2I-+H2O2+2H+=I2+2H2O,故B错误;
C.以金属银为阳极电解饱和硫酸铜溶液,阳极反应为Ag-e-=Ag+,阴极反应为Cu2++2e-=Cu,故C错误;
D.过氧化氢能使酸性KMnO4溶液褪色的离子反应为5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O,故D正确;
故选D.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意离子反应中保留化学式的物质,侧重氧化还原反应、电解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
将4g NaOH溶于水配成50mL溶液,取出5mL,这5mL溶液的物质的量浓度是( )
| A、2 mol/L |
| B、1 mol/L |
| C、0.1 mol/L |
| D、0.05 mol/L |
下列反应中属吸热反应的是( )
| A、Zn与稀硫酸反应放出氢气 |
| B、酸碱中和反应 |
| C、硫在空气或氧气中燃烧 |
| D、Ba(OH)2?8H2O与NH4Cl反应 |
下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤氯化钠熔化时离子键被破坏
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定.
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤氯化钠熔化时离子键被破坏
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定.
| A、①②③⑥ | B、①②④ |
| C、③⑤⑥ | D、③⑤ |
有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是( )
途径①Fe
FeCl2溶液
途径②Fe
FeCl3
FeCl2溶液
途径③Cl2
Na2SO4溶液
途径④Cl2
NaClO溶液
Na2SO4溶液
途径⑤S
H2SO4
途径⑥S
SO2
SO3
H2SO4.
途径①Fe
| 稀HCl |
途径②Fe
| Cl2 |
| Fe、水 |
途径③Cl2
| Na2SO3溶液 |
途径④Cl2
| NaOH溶液 |
| Na2SO3溶液 |
途径⑤S
| 浓HNO3 |
途径⑥S
| O2 |
| O2 |
| H2O |
| A、由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- |
| B、由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- |
| C、由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- |
| D、以上说法都不正确 |

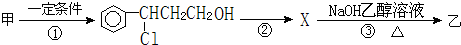
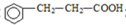 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式