题目内容
7.下列各组离子能在溶液中大量共存的是( )| A. | H+、Ba2+、Cl-、AlO2- | B. | Fe3+、SO42-、Na+、OH- | ||
| C. | Na+、OH-、SiO32-、Cl- | D. | Na+、HCO3-、SO42-、OH- |
分析 A.氢离子与偏铝酸根离子反应;
B.铁离子与氢氧根离子反应;
C.四种离子之间不反应,能够共存;
D.碳酸氢根离子与氢氧根离子反应.
解答 解:A.H+、AlO2-之间发生反应,在溶液中不能大量共存,故A错误;
B.铁离子与氢氧根离子之间反应生成氢氧化铁沉淀,在溶液中不能大量共存,故B错误;
C.Na+、OH-、SiO32-、Cl-之间不反应,在溶液中能够大量共存,故C正确;
D.HCO3-、OH-之间发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
17.下列关于一些非金属元素与化合物的说法中,正确的是( )
| A. | 浓硝酸与铜会剧烈反应,浓硝酸起到了氧化剂和酸性的作用 | |
| B. | Cl2溶于水后可以漂白有色布条,且久置后布条可以恢复原色 | |
| C. | 铁遇冷的浓硫酸钝化,说明铁和冷的浓硫酸不会发生反应 | |
| D. | NaOH可与玻璃反应,所以可以用浓NaOH溶液在玻璃上作画 |
18.某烧杯中盛有含0.1mol (NH4)Al(SO4)2的溶液,现向其中缓缓加入2mol•L-1 NaOH溶液200mL,使其充分反应,此时烧杯中铝元素的存在形式为( )
| A. | Al3+和Al(OH)3 | B. | Al(OH)3 | C. | AlO2-和Al(OH)3 | D. | AlO2- |
15.已知热化学方程式:2H2(g)+O2(g)═2H2O(g)△H1═-483.6kJ•mol-1,则对于热化学方程式:2H2O(1)=2H2(g)+O2(g)△H2═QkJ•mol-1.下列关于Q值的判断正确的是( )
| A. | Q=483.6 | B. | Q>483.6 | C. | Q<483.6 | D. | 无法确定 |
2.下列铁的化合物不可能由化合反应直接制得的是( )
| A. | FeCl2 | B. | Fe(OH)3 | C. | Fe2(SO4)3 | D. | FeCl3 |
12.下列实验能成功的是( )
①用MgCl2溶液鉴别Na2CO3和NaOH溶液
②用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液
③用观察法区别Na2O和Na2O2
④用澄清石灰水鉴别Na2CO3溶液和NaHCO3固体.
①用MgCl2溶液鉴别Na2CO3和NaOH溶液
②用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液
③用观察法区别Na2O和Na2O2
④用澄清石灰水鉴别Na2CO3溶液和NaHCO3固体.
| A. | ①②③④ | B. | ③④ | C. | ②③ | D. | ②③④ |
16.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体.下列指定溶液中微粒浓度大小比较正确的是( )
| A. | 原NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 原NH4HCO3溶液中:c(OH-)=c(H+)-c(CO32-)-c(NH3•H2O)+c(H2CO3) | |
| C. | 析出晶体后的溶液中:c(Cl-)=c(NH4+),c(Na+)=c(HCO3-) | |
| D. | 析出晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
17.碳酸锂(相对分子质量74)广泛应用于化工、冶金等行业.工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如图:
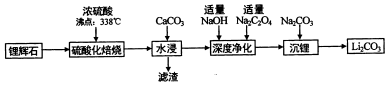
已知:碳酸锂的溶解度为((g/L)
请回答下列问题:
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2.
(2)硫酸化焙烧温度控制在250℃-300℃之间,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多.焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担.
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有CaSO4、SiO2、Al(OH)3.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4.
(5)“沉锂”需要在95℃以上进行,主耍原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.

已知:碳酸锂的溶解度为((g/L)
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)锂辉(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2.
(2)硫酸化焙烧温度控制在250℃-300℃之间,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多.焙烧中硫酸用量控制在理论用最的l15%左右,硫酸加入过多的副作用是后续中还需要除去过量的硫酸,增加后续杂质的处理量、增加后续中和酸的负担.
(3)水浸时,加入CaCO3粉末充分反应后过滤,滤渣的主要成分除CaCO3外还有CaSO4、SiO2、Al(OH)3.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4.
(5)“沉锂”需要在95℃以上进行,主耍原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.
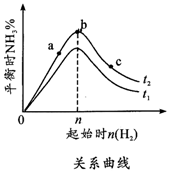 (1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).
(1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).