题目内容
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
【答案】B
【解析】
A.2NO2(g)![]() N2O4(g)△H<0,为放热反应,结合温度对化学平衡的影响分析;
N2O4(g)△H<0,为放热反应,结合温度对化学平衡的影响分析;
B.HCl不是含氧酸,盐酸酸性大于碳酸与元素周期律无关,应用高氯酸;
C.根据盖斯定律分析;
D.根据电子守恒计算生成氢气和氧气的物质的量,然后利用阿伏伽德罗定律分析。
A.2NO2(g)![]() N2O4(g)△H<0,为放热反应,热水中平衡向着逆向移动,二氧化氮浓度增大,左球气体颜色加深;冷水中平衡向着正向移动,二氧化氮浓度减小,右球气体颜色变浅,能够用勒夏特列原理解释,故A不选;
N2O4(g)△H<0,为放热反应,热水中平衡向着逆向移动,二氧化氮浓度增大,左球气体颜色加深;冷水中平衡向着正向移动,二氧化氮浓度减小,右球气体颜色变浅,能够用勒夏特列原理解释,故A不选;
B.烧瓶中冒气泡,证明酸性:HCl>碳酸,由于HCl不是含氧酸,无法用元素周期律解释,应用高氯酸,故B选;
C.根据盖斯定律:△H=△H1+△H2,能够用盖斯定律解释,故C不选;
D.根据电子守恒可知,电解水生成H2与O2的物质的量之比2:1,结合阿伏伽德罗定律可知,H2与O2的体积比约为2:1,故D不选;
故选:B。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii.CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
iii.CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)已知反应ii中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为___。
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i。图1是反应体系中CO2的平衡转化率与温度的关系曲线。

①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反应的化学反应速率为___。
②若改充入1molCO2和3mol H2,则图1中的曲线会___(填“上移”或“下移”)。
(4)某温度下在容积为2L的密闭容器中充入1molCO和2molH2合成甲醇,发生反应ii,各组分物质的量随时间的变化情况如图2所示。
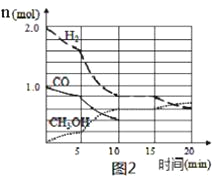
①5min至10min时速率变化的原因可能是___;
②若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是___;
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
③15min时,增加反应体系中CO的物质的量(其他条件不变),至20min时反应重新达到平衡;则新加入的CO的物质的量为___mol(保留两位有效数字)。