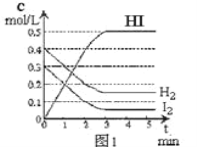
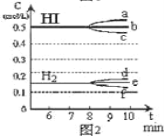
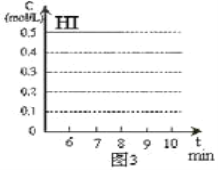
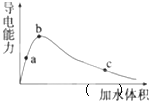
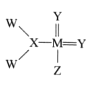
题目内容
【题目】氢镍电池是近年开发出的可充电电池,电池的总反应式为1/2 H2 + NiO(OH) ![]() Ni(OH)2 ,下列叙述正确的是( )
Ni(OH)2 ,下列叙述正确的是( )
A.电池充电时,Ni元素被还原B.电池放电时,镍元素被氧化
C.电池充电时,只有H元素被氧化D.电池放电时,氢气中氢元素被氧化
【答案】D
【解析】
可充电电池放电时发生的是原电池反应,充电时发生的是电解池反应。该电解池反应中,阴极发生还原反应,电极反应式应为2H2O+2e-=OH-+H2↑;阳极发生氧化反应,电极反应式为Ni(OH)2+OH--e-=NiO(OH)+H2O。原电池反应中的还原剂H2在负极上失电子发生氧化反应,H2-2e-2H+。根据此分析进行解答。
A.电池充电时,阳极反应为:Ni(OH)2 + OH--e-= NiO(OH) +H2O,Ni元素化合价升高,被氧化,故A选项错误。
B.放电时,镍元素化合价降低,被还原,故B选项错误。
C.充电时发生的是电解池反应。阴极发生还原反应,电极反应式应为2H2O+2e-=OH-+H2↑,H元素化合价降低,被还原,Ni元素被氧化,故C选项错误。
D.原电池反应中的还原剂H2在负极上失电子发生氧化反应,H2-2e-2H+,故D选项正确。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
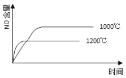
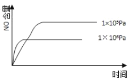
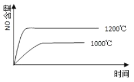
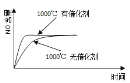
【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则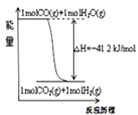 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.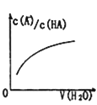 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,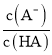 的变化情况
的变化情况