题目内容
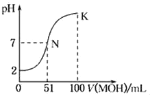
【题目】室温下,向![]() 溶液中逐滴加入NaOH溶液,所得溶液中
溶液中逐滴加入NaOH溶液,所得溶液中![]() ,
,![]() ,
,![]() 三者物质的量分数
三者物质的量分数![]() 分布系数
分布系数![]() 随PH变化的关系入图1所示。图2为不同浓度
随PH变化的关系入图1所示。图2为不同浓度![]() 溶液中部分微粒浓度。下列表述错误的是
溶液中部分微粒浓度。下列表述错误的是![]()


A.![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液PH恰好为
溶于水中,所得溶液PH恰好为![]()
C.![]() 溶液中一定存在
溶液中一定存在![]() ,同时
,同时![]()
D.在![]()
![]() 溶液中各离子浓度大小关系为:
溶液中各离子浓度大小关系为:![]()
【答案】B
【解析】
A.由![]() ,可知
,可知 ,
,![]() 时,
时,![]() ,所以
,所以![]() ,故A正确;
,故A正确;
B.如图1,c(C2O42-)= c(HC2O4-)时的溶液![]() ,溶液为酸性,说明HC2O4-的电离程度大于C2O42-的水解程度,因此投入的
,溶液为酸性,说明HC2O4-的电离程度大于C2O42-的水解程度,因此投入的![]() 、
、![]() 的物质的量相等时,溶液中
的物质的量相等时,溶液中![]() ,则溶液pH大于
,则溶液pH大于![]() ,故B错误;
,故B错误;
C.由图2可以看出,![]() 溶液显酸性,则
溶液显酸性,则![]() ,说明
,说明![]() 电离大于水解,所以电离生成的
电离大于水解,所以电离生成的![]() 大于水解生成的
大于水解生成的![]() ,故C正确;
,故C正确;
D.![]()
![]() 溶液中,lgc(
溶液中,lgc(![]() )=-1.0,Na+不会发生水解,其离子浓度最大,从图2中可以看出lgc 越大,则离子浓度越大,因此
)=-1.0,Na+不会发生水解,其离子浓度最大,从图2中可以看出lgc 越大,则离子浓度越大,因此![]() 溶液中lgc(
溶液中lgc(![]() )=-1.0时,各离子浓度大小关系为:
)=-1.0时,各离子浓度大小关系为:![]() ,故D正确;
,故D正确;
答案选B。

【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
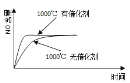
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.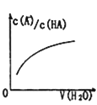 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,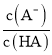 的变化情况
的变化情况
【题目】下表列出了A-F6种元素在周期表中短周期的位置。
C | D | ||||||
A | B | E | F |
请回答下列问题:
(1)C元素在周期表中的位置___;C元素的一种氧化物是温室气体,该氧化物的电子式为:___。
(2)A和B的最高价氧化物对应的水化物碱性较强的是___;(填化学式)
(3)D与同族下一周期元素的气态氢化物的沸点较高的是___(填化学式),原因是___。
(4)元素E与元素F相比,非金属性较强的是___(用元素符号填写),下列表述中能证明这一事实的是___(可多选)。
①F的氢化物比E的氢化物稳定
②常温下F的单质和E的单质状态不同
③一定条件下F和E的单质都能与氢氧化钠溶液反应
④F的氧化物的水化物的酸性比E的氧化物的水化物的酸性强
⑤F可以把E从其氢化物水溶液中置换出来
(5)元素E的一种氧化物通入氯化钡溶液无沉淀,通入硝酸钡溶液却会产生白色沉淀,写出少量该氧化物通入硝酸钡溶液的离子方程式___。