题目内容
【题目】某温度下,向25.00mL 0.1 mol·L-1NaOH溶液中滴加0.1 mol·L-1甲酸(HCOOH,弱酸)溶液,所得溶液的pH和pOH[pOH=-lg c(OH-)]的关系如图所示。下列说法正确的是( )
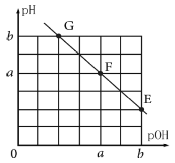
A.F点对应甲酸溶液体积V=25.00 mL
B.F点水的电离程度大于E点水的电离程度
C.温度不变,加水稀释E点溶液,c(HCOOH)/c(HCOO-)增大
D.G点对应溶液c(OH-)=102a-b mol·L-1
【答案】B
【解析】
A. F点pOH=pH,溶液呈中性,NaOH与HCOOH反应得到强碱弱酸盐,等浓度等体积反应后溶液不是中性;
B. F至E的过程中,甲酸属于过量,对水的抑制程度逐渐增大,水的电离程度逐渐减小,
C. E点溶液溶质为甲酸、甲酸钠,加水稀释过程中,溶液中c(H+)逐渐减小;
D. 由E点可知,该温度下KW=10-amol/L×10-amol/L=10-2a,G点c(H+)=10-bmol/L,根据 进行计算。
进行计算。
A、F点pOH=pH,溶液呈中性,因甲酸钠属于强碱弱酸盐,甲酸根离子水解呈碱性,故F点对应V>25.00mL,A项错误;
B、当加入甲酸溶液为25mL时,溶液中溶质为甲酸钠,此时pH>pOH,F至E的过程中,甲酸属于过量,对水的抑制程度逐渐增大,水的电离程度逐渐减小,即F点水的电离程度大于E点水的电离程度,B项正确;
C、E点溶液溶质为甲酸、甲酸钠,加水稀释过程中,溶液中c(H+)逐渐减小, ,温度不变,则Ka不变,该比值逐渐减小,C项错误;
,温度不变,则Ka不变,该比值逐渐减小,C项错误;
D、由E点可知,该温度下KW=10-amol/L×10-amol/L=10-2a,G点c(H+)=10-bmol/L,则 =10b-2amol/L,故D错误;
=10b-2amol/L,故D错误;
答案选B。

【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D