题目内容
【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii.CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
iii.CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)已知反应ii中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为___。
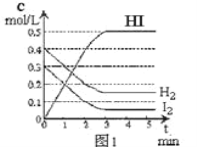
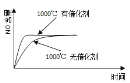
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i。图1是反应体系中CO2的平衡转化率与温度的关系曲线。

①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反应的化学反应速率为___。
②若改充入1molCO2和3mol H2,则图1中的曲线会___(填“上移”或“下移”)。
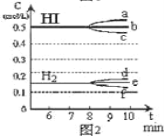
(4)某温度下在容积为2L的密闭容器中充入1molCO和2molH2合成甲醇,发生反应ii,各组分物质的量随时间的变化情况如图2所示。
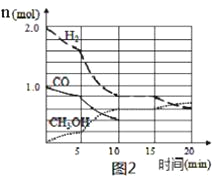
①5min至10min时速率变化的原因可能是___;
②若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是___;
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
③15min时,增加反应体系中CO的物质的量(其他条件不变),至20min时反应重新达到平衡;则新加入的CO的物质的量为___mol(保留两位有效数字)。
【答案】-99 K1=K2·K3(或者K3=![]() ) 0.03mol/(L·min) 上移 增大了压强 BD 0.53
) 0.03mol/(L·min) 上移 增大了压强 BD 0.53
【解析】
(1)根据焓变△H=反应物总键能-生成物总键能;
(2)反应i可由反应ii和反应iii加和得到,据此计算化学平衡常数间的关系;
(3)①500K时,CO2的平衡转化率为60%,起始时充入1molCO2,根据v=![]() 计算CO2的消耗速率,再根据化学反应速率之比等于化学计量数之比计算CH3OH的生成速率;
计算CO2的消耗速率,再根据化学反应速率之比等于化学计量数之比计算CH3OH的生成速率;
②若改充入1molCO2和3molH2,符合化学计量数之比,CO2的平衡转化率增大;
(4)①反应②为CO(g)+2H2(g)CH3OH(g),反应为气体分子数减少的反应,结合焓变和压强变化对化学平衡移动的改变考虑;
②反应在恒温恒压下进行,随着反应进行,体系的体积发生变化,据此逐项分析;
③15min时仅增加CO的物质的量而不改变其他条件,根据图象,20min达到平衡时,H2的物质的量为0.6mol,据此列式计算。
(1)对于反应:CO(g)+2H2(g)CH3OH(g),△H=E(C≡O)+2E(H-H)-3E(C-H)-E(C-O)-E(O-H)=-99kJ/mol;
(2)反应i可由反应ii和反应iii加和得到,则化学平衡常数的关系为:K1=K2K3;
(3)①500K时,CO2的平衡转化率为60%,起始时充入1molCO2,则CO2的消耗速率为v(CO2)=![]() =0.03mol/(Lmin),根据化学反应速率之比,则CH3OH的生成速率为v(CH3OH)=0.03mol/(Lmin);
=0.03mol/(Lmin),根据化学反应速率之比,则CH3OH的生成速率为v(CH3OH)=0.03mol/(Lmin);
②若改充入1molCO2和3molH2,符合化学计量数之比,CO2的平衡转化率增大,则曲线上移;
(4)①反应②为CO(g)+2H2(g)CH3OH(g),反应为气体分子数减少的反应,反应②焓变值小于0,则反应②为放热反应,根据图象,5-10min内CO、H2的消耗量与CH3OH的生成量满足化学计量比,因此可以判断改变的条件不是浓度项,对比0-5min,5-10min内化学反应速率是增加的,考虑升高温度和增大压强,由于反应是放热反应,升高温度导致化学平衡左移不符合图象,因此采取的措施为增大压强;
②反应在恒温恒压下进行,随着反应进行,体系的体积发生变化,据此逐项分析;
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等,单位时间内消耗CO的浓度始终与单位时间内生成CH3OH的浓度相等,不能判断化学反应是否达到平衡,故A错误;
B.混合气体的密度为ρ=![]() ,反应前后遵循质量守恒,m不变,反应为恒压容器,随着反应进行容器体积发生改变,因此混合气体的密度随着反应的进行发生改变,可以判断化学反应是否达到平衡,故B正确;
,反应前后遵循质量守恒,m不变,反应为恒压容器,随着反应进行容器体积发生改变,因此混合气体的密度随着反应的进行发生改变,可以判断化学反应是否达到平衡,故B正确;
C.体积分数为φ=![]() ,起始时充入的CO和H2是按照化学计量比充入的,反应过程中CO和H2也是按照化学计量比反应的,因此整个反应过程中CO和H2的体积分数之比不变,不能判断化学反应是否达到平衡,故C错误;
,起始时充入的CO和H2是按照化学计量比充入的,反应过程中CO和H2也是按照化学计量比反应的,因此整个反应过程中CO和H2的体积分数之比不变,不能判断化学反应是否达到平衡,故C错误;
D.混合气体的平均相对分子质量为M=![]() ,反应前后混合气体质量不变,混合气体总物质的量发生改变,因此混合气体的平均相对分子质量随着反应的进行而改变,当混合气体的平均相对分子质量不发生改变时可以判断化学反应是否达到平衡,故D正确;
,反应前后混合气体质量不变,混合气体总物质的量发生改变,因此混合气体的平均相对分子质量随着反应的进行而改变,当混合气体的平均相对分子质量不发生改变时可以判断化学反应是否达到平衡,故D正确;
故答案为:B、D;
③15min时仅增加CO的物质的量而不改变其他条件,根据图象,20min达到平衡时,H2的物质的量为0.6mol,发生的化学反应为:CO(g)+2H2(g)CH3OH(g),温度不变,化学平衡常数不变,该温度下,反应的化学平衡常数为K=![]() =
= =
=![]() L/mol,增加部分CO后,设初始时CO的物质的量为xmol,反应消耗了H2的物质的量为0.2mol,则再次达到平衡时,c(CO)=
L/mol,增加部分CO后,设初始时CO的物质的量为xmol,反应消耗了H2的物质的量为0.2mol,则再次达到平衡时,c(CO)=![]() mol/L,c(CH3OH)=0.35mol/L,K=
mol/L,c(CH3OH)=0.35mol/L,K= =
=![]() L/mol,解得x=0.93,则增加的CO的物质的量为0.93mol-0.4mol=0.53mol。
L/mol,解得x=0.93,则增加的CO的物质的量为0.93mol-0.4mol=0.53mol。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D