题目内容
15.综合利用CO2、CO对构建低碳社会有重要意义.(1)Li4SiO4可用于富集得到高浓度CO2.原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生.700℃时反应的化学方程式为Li2CO3+Li2SiO3$\stackrel{700℃}{?}$CO2+Li4SiO4.
(2)固体氧化物电解池(SOEC)用于高温电解CO2和H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图1.
①b为电源的正极(填“正极”或“负极”).
②写出电极c发生的电极反应式:CO2+2e-═CO+O2-、H2O+2e-═H2+O2-.
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g)?CH3OH(g).对此反应进行如下研究:
某温度下在一恒压容器中分别充入1.2mol CO和1mol H2,达到平衡时容器体积为2L,且含有0.4mol CH3OH(g),则该反应平衡常数值为50,此时向容器中再通入0.35mol CO气体,则此平衡将向逆反应方向(填“向正反应方向”“不”或“向逆反应方向”)移动.
(4)已知:(如图2)

若甲醇的燃烧热为△H3,试用△H1、△H2、△H3表示CO(g)+2H2(g)?CH3OH(l)的△H,则△H=△H=2△H1-△H2-△H3.
(5)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图3所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成0.1mol C(碳).
分析 (1)根据题干信息,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒进行解答;
(2)二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子;电极b氧离子失去电子发生氧化反应生成氧气;
(3)根据平衡常数的计算公式计算,恒温恒压下,体积之比等于物质的量之比,据此计算加入0.35molCO时容器的体积,计算此时浓度商,与平衡常数相比判断反应进行方向;
(4)运用盖斯定律解题;
(5)依据反应物和产物利用直平法配平化学方程式,利用已知守恒计算得到.
解答 解:(1)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以700℃时反应的化学方程式为:Li2CO3+Li2SiO3$\stackrel{700℃}{?}$CO2+Li4SiO4,
故答案为:Li2CO3+Li2SiO3$\stackrel{700℃}{?}$CO2+Li4SiO4;
(2)①CO2+H2O $\frac{\underline{\;电解\;}}{高温}$CO+H2+O2,二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,
故答案为:正极;
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O+2e-=H2+O2-,
故答案为:CO2+2e-═CO+O2-;H2O+2e-=H2+O2-;
(3)CO(g)+2H2(g)?CH3OH(g)
起始:1.2mol 1mol 0
转化:0.4mol 0.8mol 0.4mol
平衡:0.8mol 0.2mol 0.4mol
所以:k=$\frac{0.2mol/L}{0.4mol/L×(0.1mol/L)^{2}}$=50(mol/L)-2,
此时向容器中再通入0.35molCO气体,假设平衡不移动时,此时容器体积为:2L×$\frac{(0.35+0.8+0.2+0.4)mol}{(0.8+0.2+0.4)mol}$=2.5L,则浓度商Qc=$\frac{\frac{0.4}{2.5}}{\frac{1.15}{2.5}×(\frac{0.2}{2.5})^{2}}$=54.3,大于平衡常数50,平衡向逆反应方向移动,
故答案为:50;逆反应方向;
(4)由图反应Ⅰ可知H2(g)+$\frac{1}{2}$O2(g)=H2O(l),△H1;由反应Ⅱ可知:CO2(g)=CO(g)+$\frac{1}{2}$O2(g),△H2;若甲醇的燃烧热为△H3,所以CH3OH(g)+$\frac{3}{2}$O2(g)=2H2O(l)+CO2(g),△H3;所以盖斯定律,目标反应为:△H=2△H1-△H2-△H3,
故答案为:△H=2△H1-△H2-△H3;
(5)依据图示得到化学方程式为:Fe0.9O+0.1CO2=xC+$\frac{0.9}{3}$Fe3O4,
依据碳原子守恒得到x=0.1
故答案为:0.1.
点评 本题考查了热化学方程式和盖斯定律的计算和应用,电解池电极反应的分析书写,化学平衡常数的计算,原子守恒氧化还原反应的计算应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
| A. | h-g-m-n-a-b-f-e-c-d | B. | g-h-m-n-a-b-e-f-c-d | ||
| C. | h-g-c-d-m-n-f-e-a-b | D. | h-g-m-n-c-d-e-f-a-b |
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 常温常压下,28g乙烯与丁烯的混合气体含有的碳原子数目NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数小于2NA | |
| D. | 标准状况下,22.4L HF含有的分子数目为NA |
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次降低 | |
| C. | 肌醇  与葡萄糖 与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的有机物(结构如图 )最多能与含5.0 mol NaOH的水溶液完全反应 )最多能与含5.0 mol NaOH的水溶液完全反应 |
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 盐析可提纯蛋白质并保持其生理活性 | |
| D. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
| A. | 水果表面喷洒驱虫剂不招苍蝇 | B. | 自来水使用氯制剂以杀菌消毒 | ||
| C. | 牛肚用甲醛浸泡使其口感更好 | D. | 生豆芽时用植物生长激素提高产量 |
(1)
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 | |
| ① | ${\;}_{19}^{40}$K | 19 | 21 | 19 | 40 |
| ② | 3818Ar | 18 | 20 | 18 | 38 |
| ③ | 3216S2- | 16 | 16 | 18 | 32 |
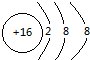 Mg2+
Mg2+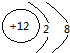 .
.  黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,是由硫与氯气在50~60℃直接化合而成.装置图如下:
黄红色液体二氯化二硫可以作为贵稀金属的萃取剂,是由硫与氯气在50~60℃直接化合而成.装置图如下: .
.