题目内容
8.能鉴别NH4Cl、K2SO4、(NH4)2SO4、NaCl 四瓶无色溶液的试剂是( )| A. | Ba(NO3)2 溶液 | B. | AgNO3 溶液 | C. | Ba(OH)2 溶液 | D. | NaOH 溶液 |
分析 只用一种试剂就能将(NH4)2SO4、NH4Cl、NaCl、K2SO4四种溶液区分开来,则所取的试剂与这四种物质混合时须有明显的不同现象,硫酸根离子和氯离子用钡离子鉴别,钾离子和铵根离子用氢氧根离子鉴别.
解答 解:A、硝酸钡溶液能与硫酸铵溶液及硫酸钾溶液产生白色沉淀,现象相同,无法鉴别,故A错误;
B.K2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液分别与硝酸银溶液反应都有白色沉淀生成,所以无法鉴别,故B错误;
C.氢氧化钡溶液与硫酸钾溶液反应生成白色沉淀,与氯化钠溶液无现象,与硫酸铵溶液反应生成白色沉淀和刺激性气味的气体,与氯化铵溶液反应生成刺激性气味的气体,所以现象不同,可以鉴别,故C正确;
D.氢氧化钠溶液能与硫酸铵溶液以及氯化铵溶液产生有刺激气味的气体,现象相同,无法鉴别,故D错误;
故选C.
点评 本题考查物质的鉴别,熟悉物质的性质及反应的不同现象即可解答,反应与现象的关系为解答的易错点,题目难度不大.

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
4.(1)常温下,用 0.1000mol•L-1NaOH溶液滴定 20.00mL 0.1000mol•L-1CH3COOH溶液所得滴定曲线如图1.已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=10-5
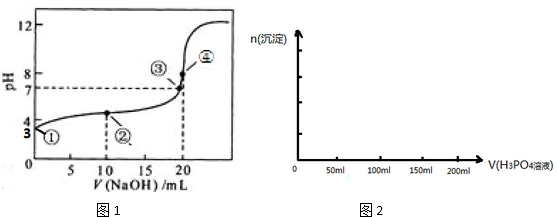
(2)在用Na2SO3溶液吸收SO2过程中,pH随n(SO32-):n(HSO32-)变化关系如下表:
0.01mol•L-1 Na2SO3溶液中通入SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
(3)向0.1mol•L的NaHSO3中通入氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-)
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1mol Ca(OH)2的澄清石灰水中逐渐加入1mol•L-1的H3PO4;请作出生成沉淀的物质的量随H3PO4滴入体积从0开始至200mL的图象.

(2)在用Na2SO3溶液吸收SO2过程中,pH随n(SO32-):n(HSO32-)变化关系如下表:
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(3)向0.1mol•L的NaHSO3中通入氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-)
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1mol Ca(OH)2的澄清石灰水中逐渐加入1mol•L-1的H3PO4;请作出生成沉淀的物质的量随H3PO4滴入体积从0开始至200mL的图象.
13.下列有关化学平衡常数K的说法中,正确的是( )
| A. | K的大小与起始浓度有关 | B. | 温度越高,K值越大 | ||
| C. | K值越大,反应正向进行的程度越大 | D. | K值越大,反应正向进行的程度越小 |
20.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水 | |
| B. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | 氯化铝是一种电解质,可用于电解法制铝 |
17.用来证明淀粉部分水解的试剂是( )
①碘水 ②KI溶液 ③银氨溶液 ④FeCl3溶液.
①碘水 ②KI溶液 ③银氨溶液 ④FeCl3溶液.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
18.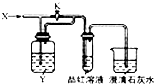 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( ) | A | B | C | D | |
| X | SO2 | Cl2 | HCl | NO2 |
| Y | NaOH溶液 | 饱和NaCO3溶液 | 饱和NaCl溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |