题目内容
3.有A、B两组溶液,共含有Na+、H+、Ag+、Ba2+、NO3-、Cl-、CO32-七种离子,已知B组离子遇稀硫酸能产生无色无味的气体,则B组溶液中含有的离子是Na+、Cl-、CO32-,写出B组离子遇稀硫酸产生气体的离子方程式CO32-+2H+=CO2↑+H2O.分析 根据B组离子遇稀硫酸能产生无色无味的气体,说明B中含有CO32-,然后根据复分解反应的条件进行分析,离子之间若能结合生成沉淀、气体或水,则不能共存进行分析.
解答 解;B组离子遇稀硫酸能产生无色无味的气体,则B中含有CO32-,则H+、Ag+、Ba2+在A组,因由于银离子能与氯离子结合生成氯化银沉淀,则B中含有Cl-以及Na+,由溶液电中性可知NO3-在A组,B组离子遇稀硫酸产生气体的离子方程式为CO32-+2H+=CO2↑+H2O,
故答案为:Na+、Cl-、CO32-;CO32-+2H+=CO2↑+H2O.
点评 本题考查离子共存知识,为高频考点,侧重于学生的分析能力的考查,解题的关键是把握离子的性质,注意溶液的电中性问题,难度不大.

练习册系列答案
相关题目
13.向明矾KAl(SO4)2.12H2O溶液里滴入Ba(OH)2溶液,当SO42-恰好完全沉淀时,其中元素的存在形式为( )
| A. | 全部形成AlO2- | B. | 全都为Al(OH)3 | ||
| C. | 一部分为Al(OH)3,一部分为Al3+ | D. | 一部分为Al(OH)3,一部分为AlO2- |
14.如图为某种乙醇燃料电池示意图,工作时电子流方向如图所示,下列判断正确的是( ) 

| A. | X为氧气 | |
| B. | 电极A反应式:CH3CH2OH-12e-+3H2O═2CO2+12H+ | |
| C. | 电极材料活泼性:A>B | |
| D. | B电极附近溶液pH增大 |
8.下列变化不属于氮的固定的是( )
| A. | 工业合成氨 | |
| B. | 雷雨闪电时,大气中产生了一氧化氮 | |
| C. | 豆科作物的根瘤菌将空气中的氮转化为氨 | |
| D. | 在一定条件下由氨气和二氧化碳合成尿素 |
8.能鉴别NH4Cl、K2SO4、(NH4)2SO4、NaCl 四瓶无色溶液的试剂是( )
| A. | Ba(NO3)2 溶液 | B. | AgNO3 溶液 | C. | Ba(OH)2 溶液 | D. | NaOH 溶液 |
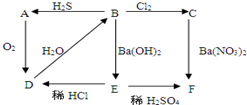 图中A为淡黄色固体,B、C为溶液,D为气体,E、F为白色沉淀.
图中A为淡黄色固体,B、C为溶液,D为气体,E、F为白色沉淀.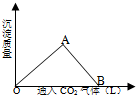 (1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.
(1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示.