题目内容
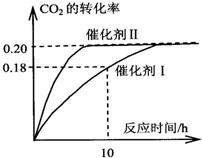 已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.3000C时的恒容密闭容器中,当C(CO2)=1.00mol.L-1C(H2)=1.60mol.L-1开始反应,结果如图所示,回答下列问题:
已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.3000C时的恒容密闭容器中,当C(CO2)=1.00mol.L-1C(H2)=1.60mol.L-1开始反应,结果如图所示,回答下列问题:(1)使用催化剂 I时,反应在10小时内的平均反应速率:V(H2)=
(2)下列叙述正确的是
A.当容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充入氩气増大压强有利于提髙CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂II比催化剂I高
D.催化效率:在上述反应条件下,催化剂II比催化剂I高
(3)根椐图中数据,计算此反应在3000C时的平衡常数
考点:转化率随温度、压强的变化曲线,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据反应在10小时内二氧化碳的转化率计算出消耗二氧化碳的物质的量浓度,再计算出用二氧化碳表示的平均反应速率,最后根据反应速率与化学计量数的关系计算出用氢气表示的反应速率;
(2)A、该反应两边都是气体,容器容积不变,所以密度始终不变;
B、充入稀有气体,不影响反应体系中各组分浓度,化学平衡不移动;
C、催化剂只影响反应速率,不影响化学平衡;
D、根据图示可知,在催化剂Ⅱ作用下的反应速率大于比催化剂Ⅰ作用下的反应速率;
(3)求出各组分浓度,根据化学平衡常数概念计算即可.
(2)A、该反应两边都是气体,容器容积不变,所以密度始终不变;
B、充入稀有气体,不影响反应体系中各组分浓度,化学平衡不移动;
C、催化剂只影响反应速率,不影响化学平衡;
D、根据图示可知,在催化剂Ⅱ作用下的反应速率大于比催化剂Ⅰ作用下的反应速率;
(3)求出各组分浓度,根据化学平衡常数概念计算即可.
解答:
解:(1)用催化剂I时,反应在10小时内二氧化碳的转化率为0.18,二氧化碳的浓度变化为:1.00mol?L-1×0.18=0.18mol/L,则反应在10小时内二氧化碳的平均反应速率为:v(CO2)=
=0.018mol?(L?h)-1,则v(H2)=3v(CO2)=0.054mol?(L?h)-1,
故答案为:0.054;
(2)A、该反应前后气体的质量不变,容器的容积固定,所以混合气体的密度始终不变,故当容器内气体的密度不再改变时,反应不一定达到平衡状态,故A正确;
B、充入氩气增大压强,但是反应体系中各组分的浓度不变,化学平衡不发生移动,所以CO2的转化率不变,故B错误;
C、催化剂不影响化学平衡,所以CO2平衡转化率在上述反应条件下,催化剂Ⅱ与催化剂Ⅰ的转化率相等,故C错误;
D、在上述反应条件下,催化剂Ⅱ的反应速率大于催化剂Ⅰ的,说明催化剂Ⅱ比催化剂Ⅰ的催化效率高,故D正确;
故选AD;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
c始(mol/L) 1.00 1.60 0 0
c变(mol/L) 0.20 0.60 0.20 0.20
c平(mol/L) 0.80 1.0 0.20 0.20
平衡常数K=
=
L2?mol-2=0.050L2?mol-2.
故答案为:0.050L2?mol-2.
| 0.18mol/L |
| 10h |
故答案为:0.054;
(2)A、该反应前后气体的质量不变,容器的容积固定,所以混合气体的密度始终不变,故当容器内气体的密度不再改变时,反应不一定达到平衡状态,故A正确;
B、充入氩气增大压强,但是反应体系中各组分的浓度不变,化学平衡不发生移动,所以CO2的转化率不变,故B错误;
C、催化剂不影响化学平衡,所以CO2平衡转化率在上述反应条件下,催化剂Ⅱ与催化剂Ⅰ的转化率相等,故C错误;
D、在上述反应条件下,催化剂Ⅱ的反应速率大于催化剂Ⅰ的,说明催化剂Ⅱ比催化剂Ⅰ的催化效率高,故D正确;
故选AD;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
c始(mol/L) 1.00 1.60 0 0
c变(mol/L) 0.20 0.60 0.20 0.20
c平(mol/L) 0.80 1.0 0.20 0.20
平衡常数K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 0.2×0.2 |
| 0.8×1.03 |
故答案为:0.050L2?mol-2.
点评:本题考查了化学反应速率、化学平衡常数的计算、影响化学反应速率因素等知识,题目难度中等,注意掌握化学反应速率、化学平衡常数的表达式及计算方法.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
 合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0
合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g)△H<0