题目内容
分类思想是学习化学的重要思想,从分类的角度分析正确的是( )
| A、SO2和NO2溶于水都显酸性,因而它们都是酸性氧化物 |
| B、Na2O和NH3的水溶液均能导电,故均为电解质 |
| C、Si和SiO2均属于原子晶体 |
| D、Na2O和Na2O2与水反应均会生成强碱,故都是碱性氧化物 |
考点:酸、碱、盐、氧化物的概念及其相互联系,不同晶体的结构微粒及微粒间作用力的区别,电解质与非电解质
专题:物质的分类专题
分析:A、酸性氧化物是指和碱反应生成盐和水的氧化物;
B、NH3溶于水后不是其本身电离出自由离子而导电,是非电解质;
C、相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体;
D、碱性氧化物是指和酸反应生成盐和水的氧化物.
B、NH3溶于水后不是其本身电离出自由离子而导电,是非电解质;
C、相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体;
D、碱性氧化物是指和酸反应生成盐和水的氧化物.
解答:
解:A、NO2与碱反应除了生成盐和水,还生成NO,故不是酸性氧化物,故A错误;
B、NH3是共价化合物,在熔融状态不导电,溶于水后不是其本身电离出自由离子而导电,故是非电解质,故B错误;
C、Si是原子晶体;二氧化硅是由硅原子和氧原子按照个数比1:2通过Si-O键构成原子晶体,故C正确;
D、Na2O2与酸反应除了生成盐和水,还生成氧气,故不是碱性氧化物,属于过氧化物,故D错误.
故选C.
B、NH3是共价化合物,在熔融状态不导电,溶于水后不是其本身电离出自由离子而导电,故是非电解质,故B错误;
C、Si是原子晶体;二氧化硅是由硅原子和氧原子按照个数比1:2通过Si-O键构成原子晶体,故C正确;
D、Na2O2与酸反应除了生成盐和水,还生成氧气,故不是碱性氧化物,属于过氧化物,故D错误.
故选C.
点评:本题考查了酸性氧化物、碱性氧化物和电解质、原子晶体的辨别,难度不大,掌握定义要点是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应中必须加入还原剂才能进行的是( )
| A、Zn→Zn2+ |
| B、Fe3+→Fe2+ |
| C、CO2→CO32- |
| D、Cl2→Cl- |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,2.24L苯中含0.6NA个氢原子 |
| B、22.4LCl2通入水中充分反应,共转移NA个电子 |
| C、1L1mol?L-1氯化铜溶液中Cu2+的数目小于NA |
| D、0.1mol铁在0.1molCl2中充分燃烧,转移的电子数为0.3NA |
下列数量的物质中含对应微粒数目最多的是( )
| A、0.4molNaCl所含离子数 |
| B、标准状况下5.6L CO2所含原子数 |
| C、1L1 mol?L-1盐酸所含HCl分子数 |
| D、10g氖气所含原子数 |
电离常数可以表示弱电解质的电离情况,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
溶度积常数可以表示难(微)溶物的溶解度情况,下表是常温下几种难(微)溶物的溶度积常数(Ksp):
下列说法正确的是( )
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HF | 3.53×10-4 |
| HCN | 5×10-10 |
| H2SO3 | Ka1=1.54×10-2;Ka2=1.02×10-7 |
| NH3?H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| Mg(OH)2 | 5.61×10-12 |
| MgCO3 | 6.82×10-6 |
| A、酸性:HF>CH3COOH>H2SO3>HCN |
| B、根据溶度积常数(Ksp),甲同学认为除NaCl溶液中少量的MgCl2杂质需要加稍过量的NaOH溶液,而不是Na2CO3溶液;乙同学认为即使在BaSO4悬浊液中加过量的纯碱溶液,BaSO4也不会转化为BaCO3 |
| C、浓度相同的NaCN溶液和HCN的溶液等体积混合,其pH>7,溶液中各离子浓度大小为:c(OH-)>c(H+)>c(Na+)>c(CN-) |
| D、CH3COONH4水溶液显中性,是因为根据电离常数,CH3COO-结合H+与NH4+结合OH-生成弱电解质的程度一样,导致水溶液中的H+与OH-浓度相等 |
235 92 |
235 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
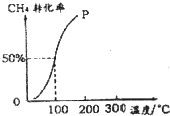 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.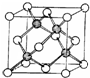 A、B、C、D、E五种元素的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;Cn-与D+具有相同的电子层结构; E原子的3d能级中成对电子数与未成对电子数之比为4:3.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;Cn-与D+具有相同的电子层结构; E原子的3d能级中成对电子数与未成对电子数之比为4:3.试回答下列问题: