题目内容
2.一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示.下列有关判断正确的是( )| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A. | SO2的平衡转化率:α1>α2=α3 | B. | SO3的物质的量浓度:c(甲)=c(丁)<c(丙) | ||
| C. | 甲、乙中的平衡常数:K(甲)=K(乙)=400 | D. | 丙、丁中的平衡常数:K(丙)<K(丁) |
分析 A.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,二氧化硫转化率减小,丙和丁达到的是相同的平衡状态,丙实验氧气物质的量增大,氧气转化率增大;
B.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,丙和丁平衡是相同的平衡;
C.温度相同,该反应的平衡常数相同,根据甲中各物质的平衡浓度计算平衡常数;
D.温度相同时,该反应的平衡常数不变.
解答 解:A.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,二氧化硫转化率减小,丙和丁达到的是相同的平衡状态,丙实验氧气物质的量增大,氧气转化率增大;则二氧化硫转化率,α1<α2=α3,故A错误;
B.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,即丙中c(SO3)大于甲中c(SO3)的2倍,丙体积为2L,丁体积为1L,起始量分别为0.8,0.48;0.40,24,丙和丁达到的平衡相同,三氧化硫浓度相同,丙=丁>甲,故B错误;
C.由于温度不变,则四个反应的平衡常数相同,根据甲可知,
2SO2(g)+O2(g)?2SO3(g),
开始(mol) 0.4 0.24 0
转化(mol) 0.32 0.16 0.32
平衡(mol) 0.08 0.08 0.32
平衡浓度(mol/L)0.04 0.04 0.16
所以该温度下,平衡常数值为:K=$\frac{0.1{6}^{2}}{0.0{4}^{2}×0.04}$=400,故C正确;
D.温度相同时,该反应的平衡常数不变,则甲、乙中反应的平衡常数相等,故D错误;
故选C.
点评 本题考查化学平衡的计算,题目难度中等,熟悉化学平衡的三段法计算及影响平衡移动的因素即可解答,注意平衡常数只与温度有关,与浓度大小无关,试题培养了学生的灵活应用能力.

| A. | 向某溶液中滴加KSCN溶液,变为血红色,则原溶液中含有Fe3+ | |
| B. | 向某溶液中滴加NaOH溶液,生成白色沉淀,继而变为灰绿色,最终变为红褐色,则原溶液中含有Fe2+ | |
| C. | 将淀粉和氯化钠的混合溶液装入半透膜中,将半透膜浸泡在盛有蒸馏水的烧杯中,为检验半透膜是否破损,可向蒸馏水中加入硝酸银溶液来验证 | |
| D. | 硫酸亚铁溶液中,常放入一些铁粉 |
| A. | 若实验室发生火灾,应立即打开门窗(或排风扇)通风透气 | |
| B. | 实验结束后,用嘴吹熄酒精灯 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断的搅拌 |
| A. | NH3分子比PH3分子稳定 | B. | 通常情况NH3极易溶于水 | ||
| C. | 氨易液化 | D. | H2O的沸点比H2S的沸点高 |
| A. | 蛋白质都能与浓硝酸发生显色反应 | |
| B. | 糖类不都能发生水解反应 | |
| C. | 油脂都不能使溴的四氯化碳溶液退色 | |
| D. | 水是营养物质 |
(2)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
①该反应的△H<0 (填“>”“<”或“=”),1150℃时,当CO、CO2浓度均为1.0mol/L时,化学平衡向(填“正向”、“逆向”或“不移动”)正向移动.
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006mol•L-1•min-1;CO的转化率=60%.
③欲提高$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)中CO的平衡转化率,可采取的措施是C.
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂.
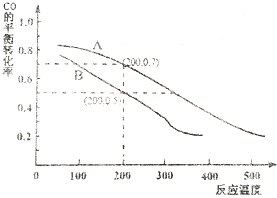
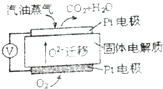
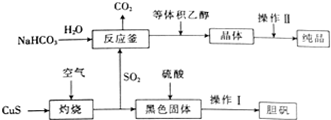 硫及其化合物在生产及生活中有着广泛的应用.
硫及其化合物在生产及生活中有着广泛的应用.