题目内容
14.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )| A. | 向试管中滴加盐酸和BaCl2溶液,生成白色沉淀,说明原溶液中有SO42- | |
| B. | 向试管中加硝酸银溶液,生成白色沉淀,再滴加足量硝酸,沉淀不溶解,说明原溶液中有Cl- | |
| C. | 向试管中用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,未观察到紫色,说明原溶液中有Na+,不可能有K+ | |
| D. | 向试管中滴加稀的NaOH溶液,置于试管口的湿润红色石蕊试纸不变蓝,说明原溶液中无NH4+ |
分析 A.白色沉淀可能为AgCl;
C.白色沉淀为AgCl,不溶于硝酸;
C.观察K的焰色反应,需要透过蓝色的钴玻璃观察;
D.若含NH4+,滴加稀的NaOH溶液,且没有加热,不能生成氨气.
解答 解:A.白色沉淀可能为AgCl,不能说明原溶液中有SO42-,检验SO42-,应先加盐酸无现象,后加氯化钡生成白色沉淀,故A错误;
C.白色沉淀为AgCl,不溶于硝酸,则沉淀不溶解,说明原溶液中有Cl-,故B正确;
C.观察K的焰色反应,需要透过蓝色的钴玻璃观察,则由现象可知,原溶液中有Na+,不能确定是否有K+,故C错误;
D.若含NH4+,滴加稀的NaOH溶液,且没有加热,不能生成氨气,则实验操作不合理,不能检验铵根离子,故D错误;
故选B.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象和结论为解答的关键,侧重分析与应用能力的考查,注意排除干扰离子,题目难度不大.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | CaCl2晶体中的只含离子键 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | N2和HCl两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 L 1 mol•L-1 K2SO4溶液中含有的钾离子数为2NA | |
| B. | 1mol氯气完全反应生成氯离子得到的电子数为NA | |
| C. | 22 g CO2中含有的分子数为NA | |
| D. | 常温常压下,22.4 L N2中含有的分子数为NA |
9.气体的体积主要由什么因素决定的( )
①气体分子的大小 ②气体分子数的多少 ③气体分子间的平均距离④气体分子的相对分子质量.
①气体分子的大小 ②气体分子数的多少 ③气体分子间的平均距离④气体分子的相对分子质量.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
19.设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| B. | 标准状况下,22.4 LSO3与水反应生成1mol硫酸 | |
| C. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| D. | 足量铜与18mol•L-11L浓硫酸反应可以得到SO2的分子总数为9NA |
16.下列气体中,不能用浓硫酸作干燥剂的是( )
①HCl; ②NH3; ③Cl2; ④H2; ⑤H2S; ⑥SO2.
①HCl; ②NH3; ③Cl2; ④H2; ⑤H2S; ⑥SO2.
| A. | ②④⑤⑥ | B. | ①②⑤ | C. | ②⑤ | D. | ①②④⑤ |

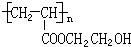 .
.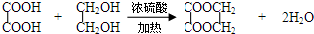 .
.


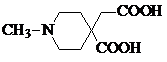 .
.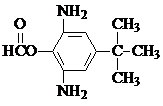 或
或 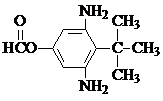 .
. 和CH3CH2Cl为原料制备
和CH3CH2Cl为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: