题目内容
14.C、Si、S都是自然界中含量丰富的非金属元素,下列关于其单质及其化合物的说法中正确的是( )| A. | 三种元素在自然界中既有游离态又有化合态 | |
| B. | 二氧化物都属于酸性氧化物,能与碱反应而不能与任何酸反应 | |
| C. | 最低价的气态氢化物都具有还原性 | |
| D. | 其最高价氧化物对应水化物的酸性强弱:H2SO4>H2SiO3>H2CO3 |
分析 A.Si是亲氧元素,在自然界中没有游离态的Si存在;
B.二氧化硅能和HF反应,二氧化硫能和H2S反应;
C.这几种最低价的气态氢化物都能被氧化;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A.Si是亲氧元素,在自然界中没有游离态的Si存在,以二氧化硅和硅酸盐的形式存在,故A错误;
B.二氧化硅能和HF反应,二氧化硫能和H2S反应生成S单质,故B错误;
C.这几种最低价的气态氢化物都能被氧化,所以都具有还原性,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性S>C>Si,所以酸性强弱:H2SO4>H2CO3>H2SiO3,故D错误;
故选C.
点评 本题考查非金属元素及元素周期律,为高频考点,明确元素及物质性质、元素周期律是解本题关键,注意二氧化硅性质的特殊性,知道非金属性强弱判断方法,题目难度不大.

练习册系列答案
 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
4.ag气体X与bg气体Y的分子数相同,下列说法正确的是( )
| A. | 同温同压下,等质量的X和Y体积之比为b:a | |
| B. | 标准状况下,气体X和气体Y的密度之比为b:a | |
| C. | 同温体积时,1g气体X和1g气体Y对容器的压强之比为a:b | |
| D. | 同物质的量的气体X和气体Y的质量之比为b:a |
5.往NH4NO3溶液加入少量Na2O固体,溶液中微粒的数目不变的是( )
| A. | NH4+ | B. | H+ | C. | NO3- | D. | H2O |
2.由C5H10、C3H6O2和C6H12O6组成的混合物,经测定含氧元素的质量分数为x,则此混合物中含碳元素的质量分数为( )
| A. | $\frac{6(1-x)}{7}$ | B. | $\frac{1-x}{7}$ | C. | $\frac{3x}{4}$ | D. | 无法计算 |
6.NA表示阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 常温常压下,16g O3所含的原子数为NA | |
| B. | 标准状况下,11.2 L NO和11.2 L O2混合后气体的分子总数为NA | |
| C. | 常温下,pH=2的稀盐酸中所含有的H+离子数等于0.01 NA | |
| D. | 加热条件下,20mL 10 mol/L 浓硝酸与足量铜反应转移电子数等于0.2NA |
3.下列化合物中,既能发生水解反应,又能发生消去反应,且消去反应生成的烯烃不存在同分异构体的是( )
| A. | CH3Cl | B. |  | C. |  | D. |  |
6.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 无色溶液中:Na+、Cl-、SO42-、Fe3+ | |
| B. | 在强酸性的溶液中:Na+、SO42-、Cl-、NH4+ | |
| C. | 使紫色石蕊试液变红的溶液中:Na+、Mg2+、CO32-、Cl- | |
| D. | 含SO42-的水溶液中:K+、Ba2+、Cl-、Br- |

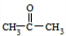 +2H2O;
+2H2O;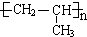 .
.