题目内容
某恒容密闭容器内发生可逆反应为:2NO2?N2O4,下列状态不能说明该反应达到平衡的标志是( )
| A、平均相对分子质量不再发生改变 |
| B、压强不再发生改变 |
| C、密度不再发生改变 |
| D、容器内的气体的颜色不再变化 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:可逆反应达到平衡状态,一定满足正逆反应速率相等且不为零,各组分的浓度不再变化;该反应的特点为:一是可逆反应;二是反应前后气体体积不相等.
解答:
解:A、反应前后气体的化学计量数之和不相等,气体的物质的量为一个变量,气体的质量不变,则混合气体的平均对分子质量不再改变,故A不符合;
B、2NO2?N2O4,反应前后气体体积发生改变,压强不变说明反应达到平衡状态,故B不符合;
C、反应前后气体质量守恒,容器体积不变,密度不变,因此混合气体的密度不再改变不能说明反应达到平衡,故C符合;
D、混合气体中二氧化氮是红棕色气体,颜色变化,浓度改变,混合气体颜色保持不变,说明反应达到平衡,故D不符合;
故选:C.
B、2NO2?N2O4,反应前后气体体积发生改变,压强不变说明反应达到平衡状态,故B不符合;
C、反应前后气体质量守恒,容器体积不变,密度不变,因此混合气体的密度不再改变不能说明反应达到平衡,故C符合;
D、混合气体中二氧化氮是红棕色气体,颜色变化,浓度改变,混合气体颜色保持不变,说明反应达到平衡,故D不符合;
故选:C.
点评:本题考查了化学平衡状态的判断,难度不大,注意根据可逆反应的特点和相关计算公式分析问题.

练习册系列答案
 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
下列各组物质的性质变化正确的是( )
| A、酸性HClO4>H3PO4>HNO3>H2SiO4 |
| B、稳定性H2S>HCl>HBr>HI |
| C、还原性Rb>K>Na>Li |
| D、碱性Al(OH)3>Mg(OH)2>NaOH |
 关于如图装置的叙述,正确的是( )
关于如图装置的叙述,正确的是( )| A、铝是负极,铝片上析出无色气体 |
| B、溶液中两电极间产生白色沉淀 |
| C、溶液中先产生白色沉淀,最后沉淀溶解 |
| D、石墨是正极,石墨棒上析出黄绿色气体 |
NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1.OL 1.0mo1?L-1的Na2CO3水溶液中含有的氧原子数为3NA |
| B、25℃时pH=13的NaOH溶液中含有Na+的数目为0.1NA |
| C、28g晶体硅中含有化学键的个数为2NA |
| D、1mol的羟基与1mol的氢氧根离子所含电子数均为10NA |
设NA为阿伏伽德罗常数,下列说法中正确的是( )
| A、0.1mol过氧化钠固体中含阴离子个数为0.2NA |
| B、1mol金刚石中含C-C的数目为4NA |
| C、标准状况下,22.4L乙炔中含π键数为2NA |
| D、1molNaHSO4晶体中阳离子数为2NA |
下列各溶液中能大量共存的离子组是( )
| A、碳酸氢钠溶液中:K+、SO42-、Cl-、H+ |
| B、使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- |
| C、使酚酞试液呈红色的溶液中:Mg2+、Cu2+、SO42-、K+ |
| D、c(H+)=10-14mol/L的溶液中:Na+、AlO2-、S2-、SO32- |



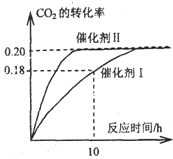 I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:
I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题: