题目内容
下图所示反应I、反应Ⅱ和反应Ⅲ均是工业生产中常见的反应.其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应Ⅲ和E与G反应的原理相同.

回答下列问题:
(1)C与J的水溶液反应后生成的含氧酸的电子式是 .
(2)反应Ⅱ的离子方程式为 .
(3)反应Ⅲ的化学方程式为 .
(4)E与G反应的离子方程式是 .
(5)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是 .
(6)工业上测定反应Ⅲ产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果.
①用Na2S2O3标准溶液滴定I2时选用的指示剂是 .
②生成I2的反应的离子方程式是 .

回答下列问题:
(1)C与J的水溶液反应后生成的含氧酸的电子式是
(2)反应Ⅱ的离子方程式为
(3)反应Ⅲ的化学方程式为
(4)E与G反应的离子方程式是
(5)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是
(6)工业上测定反应Ⅲ产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果.
①用Na2S2O3标准溶液滴定I2时选用的指示剂是
②生成I2的反应的离子方程式是
考点:无机物的推断
专题:推断题
分析:A、B为化合物,C是温室气体之一为CO2,D和K均可用做干燥剂结合反应条件判断为D为CaO,A为CaCO3,H常温下为液态化合物推断为H2O,M为Ca(OH)2,J是一种具有漂白作用的盐推断为Ca(ClO)2,K为CaCl2,E为Cl2,反应Ⅲ和E与G反应的原理相同,说明G为碱,结合反应条件,可以推断B为NaCl,电解溶液反应生成产物G为NaOH,F为H2,据此解答.
解答:
解:A、B为化合物,C是温室气体之一为CO2,D和K均可用做干燥剂结合反应条件判断为D为CaO,A为CaCO3,H常温下为液态化合物推断为H2O,M为Ca(OH)2,J是一种具有漂白作用的盐推断为Ca(ClO)2,K为CaCl2,E为Cl2,反应Ⅲ和E与G反应的原理相同,说明G为碱,结合反应条件,可以推断B为NaCl,电解溶液反应生成产物G为NaOH,F为H2,
(1)CO2 与Ca(ClO)2溶液反应为CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO,反应后生成的含氧酸为HClO,次氯酸的电子式是: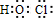 ,
,
故答案为: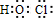 ;
;
(2)反应Ⅱ是电解氯化钠溶液生成氯气、氢气与氢氧化钠,离子方程式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(3)反应Ⅲ是氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水,化学方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(4)E与G反应是氯气和氢氧化钠溶液的反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)J(Ca(ClO)2)久置后,即便不接触水、空气,本身也逐渐分解生成K(CaCl2),并放出气体,该气体为氧气,该反应的化学方程式:Ca(ClO)2=CaCl2+O2↑,
故答案为:Ca(ClO)2=CaCl2+O2↑;
(6)①碘单质遇淀粉溶液变蓝,用Na2S2O3标准溶液滴定I2时选用的指示剂为淀粉,随着Na2S2O3标准溶液的滴入,蓝色褪去,
故答案为:淀粉溶液;
②生成I2的反应的离子方程式为:ClO-+2I-+2H+=Cl-+I2+H2O,
故答案为:ClO-+2I-+2H+=Cl-+I2+H2O.
(1)CO2 与Ca(ClO)2溶液反应为CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO,反应后生成的含氧酸为HClO,次氯酸的电子式是:
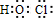 ,
,故答案为:
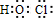 ;
;(2)反应Ⅱ是电解氯化钠溶液生成氯气、氢气与氢氧化钠,离子方程式为:2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
(3)反应Ⅲ是氯气与氢氧化钙反应生成氯化钙、次氯酸钙与水,化学方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(4)E与G反应是氯气和氢氧化钠溶液的反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)J(Ca(ClO)2)久置后,即便不接触水、空气,本身也逐渐分解生成K(CaCl2),并放出气体,该气体为氧气,该反应的化学方程式:Ca(ClO)2=CaCl2+O2↑,
故答案为:Ca(ClO)2=CaCl2+O2↑;
(6)①碘单质遇淀粉溶液变蓝,用Na2S2O3标准溶液滴定I2时选用的指示剂为淀粉,随着Na2S2O3标准溶液的滴入,蓝色褪去,
故答案为:淀粉溶液;
②生成I2的反应的离子方程式为:ClO-+2I-+2H+=Cl-+I2+H2O,
故答案为:ClO-+2I-+2H+=Cl-+I2+H2O.
点评:本题考查无机物推断,注意掌握中学常见的工业生产原理,根据物质性质的应用、反应特征条件和产物性质进行推断,题目难度中等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1.OL 1.0mo1?L-1的Na2CO3水溶液中含有的氧原子数为3NA |
| B、25℃时pH=13的NaOH溶液中含有Na+的数目为0.1NA |
| C、28g晶体硅中含有化学键的个数为2NA |
| D、1mol的羟基与1mol的氢氧根离子所含电子数均为10NA |
 硼化钒-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时的反应为:4VB2+11O2═4B2O3+2V2O5,下列说法正确的是( )
硼化钒-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时的反应为:4VB2+11O2═4B2O3+2V2O5,下列说法正确的是( )| A、电极a是电源负极 |
| B、溶液中的OH向a极移动 |
| C、电子由VB2极经KOH溶液流向电极a |
| D、VB2极发生的电极反应为:2VB2+22OH-═V2O5+2B2O3+11H2O+22e- |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,11.2LH2O含有的分子数为0.5NA |
| B、含有NA个氦原子的氦气在标准状况下的体积约为l1.2L |
| C、25℃、l标准大气压下,64gSO2中含有的原子数为3NA |
| D、在常温常压下,11.2LCl2含有的分子数为0.5NA |
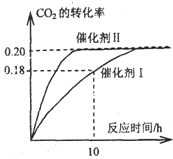 I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:
I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:


