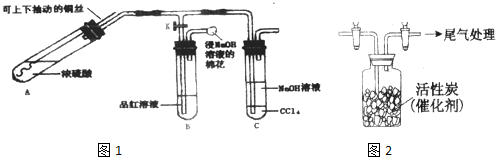
题目内容
用1.0mol?L-1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好完全反应后溶液的总体积分别是(设二者混合后体积为二者体积之和)( )

| A、0.5mol?L-1 160mL |
| B、1.0mol?L-1 160mL |
| C、0.5mol?L-1 80mL |
| D、1.0mol?L-180mL |
考点:中和滴定
专题:
分析:先根据硫酸溶液的pH确定氢离子浓度,再根据硫酸和氢离子之间的关系式确定硫酸浓度,最后根据硫酸和氢氧化钠反应的关系式计算氢氧化钠溶液的体积,硫酸和氢氧化钠溶液体积就是完全反应后溶液的总体积.
解答:
解:根据图象知,硫酸的pH=0,则c(H+)=1mol/L,c(H2SO4)=
c(H+)=0.5mol/L;完全反应时氢氧化钠溶液的体积为80mL,根据反应中氢氧化钠和硫酸的关系式得:n(NaOH)=2n(H2SO4)=2×0.5mol/L×0.08L=1mol/L×V,所以V(NaOH)=
=80mL,则混合溶液体积=80mL×2=160mL,故选A.
| 1 |
| 2 |
| 2×0.5mol/L×0.08L |
| 1mol/L |
点评:本题考查了物质的量的有关计算,根据曲线中pH确定硫酸浓度,再结合硫酸和氢氧化钠的关系式进行解答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、在标准状况下,2.24 L H2O中含有0.1 NA个水分子 |
| B、0.1mol/LNaCl溶液中含有Na+数为0.1NA |
| C、1molFe与足量盐酸完全反应,Fe失去的电子数为2NA |
| D、在常温下,1molH2含有的原子数一定不是2NA |
关于 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A、其M电子层上的电子为8个 |
| B、该元素位于第三周期第ⅥA族 |
| C、最高正化合价为+2价 |
| D、该元素是长周期元素 |
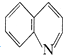 )是一种重要的有机化合物,其合成路线如下:
)是一种重要的有机化合物,其合成路线如下: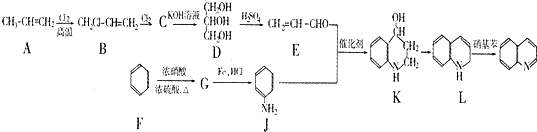
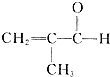 制备物质K的同系物:
制备物质K的同系物:



 ,合成路线是
,合成路线是