题目内容
某研究学习小组利用如图1装置进行铜与浓硫酸反应的产物及有关产物性质的探究实验.
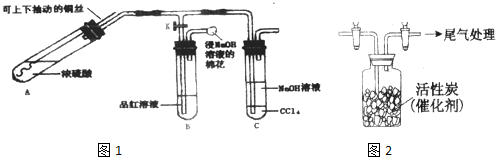
(Ⅰ)实验步骤与现象如下:
①检查装置气密性,向A中加入5mL浓硫酸.打开K,将铜丝伸入浓硫酸中,给A处加热,观察到B中品红溶液褪色,再关闭K.
②实验观察到A中液面下铜丝变黑,产生气泡,液面上方产生大量白雾,一段时间后溶液中有白色固体出现,拉出铜丝,停止加热.
回答下列问题:
(1)溶液中白色固体是 (填化学式),C中CCl4的作用是 .
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝.写出A中可能发生反应的化学方程式: 、 .
(3)分离出C中的上层液体的操作名称为: .
(Ⅱ)依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.用如图2所示装置收集满Cl2,再通入SO2,集气瓶中立即产生无色液体,充分反应后,将液体和剩余气体分离,进行如下研究.
(1)研究反应的产物,向所得液体中加水,出现白雾,振荡、静置得到无色溶液,经检验该溶液中的阴离子(除OH-外)只有SO42、Cl-,证明无色液体是SO2Cl2.
①写出SO2Cl2与H2O反应的化学方式 .
②检验该溶液中Cl-的方法是 .
(2)继续研究反应进行的程度,用NaOH溶液吸收分离出的气体,用稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀.
①该白色沉淀的成分是 .
②写出SO2与Cl2反应的化学方程式 ,并阐述理由 .

(Ⅰ)实验步骤与现象如下:
①检查装置气密性,向A中加入5mL浓硫酸.打开K,将铜丝伸入浓硫酸中,给A处加热,观察到B中品红溶液褪色,再关闭K.
②实验观察到A中液面下铜丝变黑,产生气泡,液面上方产生大量白雾,一段时间后溶液中有白色固体出现,拉出铜丝,停止加热.
回答下列问题:
(1)溶液中白色固体是
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝.写出A中可能发生反应的化学方程式:
(3)分离出C中的上层液体的操作名称为:
(Ⅱ)依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.用如图2所示装置收集满Cl2,再通入SO2,集气瓶中立即产生无色液体,充分反应后,将液体和剩余气体分离,进行如下研究.
(1)研究反应的产物,向所得液体中加水,出现白雾,振荡、静置得到无色溶液,经检验该溶液中的阴离子(除OH-外)只有SO42、Cl-,证明无色液体是SO2Cl2.
①写出SO2Cl2与H2O反应的化学方式
②检验该溶液中Cl-的方法是
(2)继续研究反应进行的程度,用NaOH溶液吸收分离出的气体,用稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀.
①该白色沉淀的成分是
②写出SO2与Cl2反应的化学方程式
考点:性质实验方案的设计,浓硫酸的性质实验
专题:实验题
分析:(I)(1)无水CuSO4是白色固体;有缓冲作用的装置能防止倒吸;
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝,说明黑色物质和稀硫酸反应且得到CuSO4溶液,则黑色物质是CuO,在加热条件下,Cu能和硫酸反应生成CuSO4还能生成CuO,同时生成SO2;
(3)分离互不相溶的液体采用分液方法分离;
(II)(1)①经检验该溶液中的阴离子(除OH-外)只有SO42、Cl-,证明无色液体是SO2Cl2,说明SO2Cl2和水反应生成硫酸和盐酸;
②先除去硫酸根离子的干扰,再用硝酸酸化的硝酸银溶液检验氯离子,如果产生白色沉淀就证明含有氯离子,否则不含氯离子;
(2)①盐酸酸化的溶液中不含亚硫酸根离子等,和BaCl2溶液中Ba2+反应的离子只有SO42-;
②白色沉淀是BaSO4,说明反应后的混合气体中含有SO2、Cl2,同时容器中还有SO2Cl2,则该反应是可逆反应.
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝,说明黑色物质和稀硫酸反应且得到CuSO4溶液,则黑色物质是CuO,在加热条件下,Cu能和硫酸反应生成CuSO4还能生成CuO,同时生成SO2;
(3)分离互不相溶的液体采用分液方法分离;
(II)(1)①经检验该溶液中的阴离子(除OH-外)只有SO42、Cl-,证明无色液体是SO2Cl2,说明SO2Cl2和水反应生成硫酸和盐酸;
②先除去硫酸根离子的干扰,再用硝酸酸化的硝酸银溶液检验氯离子,如果产生白色沉淀就证明含有氯离子,否则不含氯离子;
(2)①盐酸酸化的溶液中不含亚硫酸根离子等,和BaCl2溶液中Ba2+反应的离子只有SO42-;
②白色沉淀是BaSO4,说明反应后的混合气体中含有SO2、Cl2,同时容器中还有SO2Cl2,则该反应是可逆反应.
解答:
解:(I)(1)无水CuSO4是白色固体,浓硫酸具有吸水性,吸收混合物中水分导致有无水硫酸铜析出,所以看到有白色固体析出;SO2属于酸性氧化物,不溶于四氯化碳但能溶于NaOH溶液,所以四氯化碳有缓冲作用,能防止倒吸,故答案为:CuSO4;防倒吸;
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝,说明黑色物质和稀硫酸反应且得到CuSO4溶液,则黑色物质是CuO,在加热条件下,Cu能和硫酸反应生成CuSO4还能生成CuO,同时生成SO2,所以涉及的反应方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O Cu+H2SO4(浓)
CuO+SO2↑+H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;Cu+H2SO4(浓)
CuO+SO2↑+H2O;
(3)分离互不相溶的液体采用分液方法分离,NaOH溶液和四氯化碳不互溶,所以可以采用分液的方法分离,故答案为:分液;
(II)(1)①经检验该溶液中的阴离子(除OH-外)只有SO42、Cl-,证明无色液体是SO2Cl2,说明SO2Cl2和水反应生成硫酸和盐酸,反应方程式为SO2Cl2+2HCl=2HCl+H2SO4,故答案为:SO2Cl2+2HCl=2HCl+H2SO4;
②先除去硫酸根离子的干扰,再用硝酸酸化的硝酸银溶液检验氯离子,如果产生白色沉淀就证明含有氯离子,否则不含氯离子,其检验方法是:取少量该溶液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中滴加硝酸酸化再加入硝酸银溶液,若产生白色沉淀,就说明溶液中含有Cl-,
故答案为:取少量该溶液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中滴加硝酸酸化再加入硝酸银溶液,若产生白色沉淀,就说明溶液中含有Cl-;
(2)①盐酸酸化的溶液中不含亚硫酸根离子等,和BaCl2溶液中Ba2+反应的离子只有SO42-,所以生成的白色沉淀是BaSO4,故答案为:BaSO4;
②白色沉淀是BaSO4,说明反应后的混合气体中含有SO2、Cl2,同时容器中还有SO2Cl2,同一容器中含有反应物和生成物,所以该反应是可逆反应,反应方程式为SO2+Cl2?SO2Cl2,
故答案为:SO2+Cl2?SO2Cl2;白色沉淀是BaSO4,说明反应后的混合气体中含有SO2、Cl2,同时容器中还有SO2Cl2,则该反应是可逆反应.
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝,说明黑色物质和稀硫酸反应且得到CuSO4溶液,则黑色物质是CuO,在加热条件下,Cu能和硫酸反应生成CuSO4还能生成CuO,同时生成SO2,所以涉及的反应方程式为Cu+2H2SO4(浓)
| ||
| ||
故答案为:Cu+2H2SO4(浓)
| ||
| ||
(3)分离互不相溶的液体采用分液方法分离,NaOH溶液和四氯化碳不互溶,所以可以采用分液的方法分离,故答案为:分液;
(II)(1)①经检验该溶液中的阴离子(除OH-外)只有SO42、Cl-,证明无色液体是SO2Cl2,说明SO2Cl2和水反应生成硫酸和盐酸,反应方程式为SO2Cl2+2HCl=2HCl+H2SO4,故答案为:SO2Cl2+2HCl=2HCl+H2SO4;
②先除去硫酸根离子的干扰,再用硝酸酸化的硝酸银溶液检验氯离子,如果产生白色沉淀就证明含有氯离子,否则不含氯离子,其检验方法是:取少量该溶液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中滴加硝酸酸化再加入硝酸银溶液,若产生白色沉淀,就说明溶液中含有Cl-,
故答案为:取少量该溶液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中滴加硝酸酸化再加入硝酸银溶液,若产生白色沉淀,就说明溶液中含有Cl-;
(2)①盐酸酸化的溶液中不含亚硫酸根离子等,和BaCl2溶液中Ba2+反应的离子只有SO42-,所以生成的白色沉淀是BaSO4,故答案为:BaSO4;
②白色沉淀是BaSO4,说明反应后的混合气体中含有SO2、Cl2,同时容器中还有SO2Cl2,同一容器中含有反应物和生成物,所以该反应是可逆反应,反应方程式为SO2+Cl2?SO2Cl2,
故答案为:SO2+Cl2?SO2Cl2;白色沉淀是BaSO4,说明反应后的混合气体中含有SO2、Cl2,同时容器中还有SO2Cl2,则该反应是可逆反应.
点评:本题以铜和浓硫酸反应为载体考查性质实验方案设计,侧重考查实验操作、性质的分析,涉及物质的性质、可逆反应、离子检验等知识点,综合性较强,明确实验原理是解本题关键,熟练掌握元素化合物性质,题目难度中等.

练习册系列答案
相关题目
下列各组物质中属于同分异构体的是( )
| A、35Cl和37Cl |
| B、金刚石和石墨 |
| C、丁烷和2-甲基丙烷 |
| D、甲烷和丁烷 |
下列措施和节能减排无关的是( )
| A、将白炽灯换成节能灯 |
| B、发展利用新能源,如太阳能、氢能、核能等 |
| C、大力植树造林,增加绿色植被 |
| D、少开汽车,采取骑自行车或做公交车 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol Na2O2晶体中共含有4NA个离子 |
| B、常温常压下16 g O2和O3混合气体含有NA个氧原子 |
| C、0.1 mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| D、17 g的氢氧根离子中含有的电子数为9NA |
将等质量的一小块钠分别投入等体积等浓度的HCl、H2SO4、H3PO4中,标准情况下生成氢气体积之比为( )
| A、1:1:1 |
| B、1:2:3 |
| C、3:2:1 |
| D、6:3:2 |
用1.0mol?L-1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好完全反应后溶液的总体积分别是(设二者混合后体积为二者体积之和)( )

| A、0.5mol?L-1 160mL |
| B、1.0mol?L-1 160mL |
| C、0.5mol?L-1 80mL |
| D、1.0mol?L-180mL |