题目内容
13.下列电子式正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A、Na2O2为离子化合物,由2个钠离子和1个过氧根构成;
B、H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键;
C、Ba(OH)2是离子化合物,由Ba2+离子和2个OH-离子构成,相同离子不能合并;
D、CO2是共价化合物,碳原子和氧原子之间有2对电子.
解答 解:A、Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为 ,故A错误;
,故A错误;
B、H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ,故B错误;
,故B错误;
C、Ba(OH)2是离子化合物,由Ba2+离子和2个OH-离子构成,Ba(OH)2的电子式为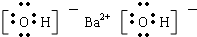 ,故C正确;
,故C正确;
D、CO2是共价化合物,碳原子和氧原子之间有2对电子,其电子式为 ,故D错误.
,故D错误.
故选C.
点评 本题考查了电子式的书写,题目比较简单,注意共价化合物和离子化合物的电子式书写的差别.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
17.糖类、油脂、蛋白质和维生素都是人类的基本营养物质.
①有些学生偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取维生素(选填“脂肪”、“维生素”或“蛋白质”)不足引起的.
②下表为某品牌燕麦片标签中的一部分.
燕麦片的营养成分中的蛋白质能水解成氨基酸;每克营养物质氧化时放出能量最多的是油脂;葡萄糖在人体内发生氧化反应的化学方程式:C6H12O6+6O2→6CO2+6H2O;人体必需的微量元素是锌.
①有些学生偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取维生素(选填“脂肪”、“维生素”或“蛋白质”)不足引起的.
②下表为某品牌燕麦片标签中的一部分.
| 每100g含有 营养成分 | 糖类 | 油脂 | 蛋白质 | 维生素C | 钙 | 镁 | 钠 | 锌 |
| 7.6g | 7.8g | 7.4g | 18mg | 201mg | 18.2mg | 30.8mg | 8.1mg |
1.绿色化学又称环境友好化学,它的主要特点之一是:提高原子的利用率,使原料中所有的原子全部转化到产品中,实现“零排放”.下列反应符合绿色化学这一特点的是( )
| A. | 工业冶铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| B. | 用生石灰制熟石灰CaO+H2O=Ca(OH)2 | |
| C. | 实验室制取二氧化碳CaCO3+2HCl=CaCl2+H2O+CO2↑ | |
| D. | 实验室制取氢气Zn+H2SO4=ZnSO4+H2↑ |
8.某元素原子序数为85,下面关于该元素说法不正确的是( )
| A. | 它的银盐不溶于水 | |
| B. | 它的氢化物很不稳定 | |
| C. | 它的单质是白色固体 | |
| D. | 该元素位于元素周期表第六周期、第十七列 |
5.R、M、T、G、J为原子序数依次递增的同一短周期主族元素,下列说法一定正确的是(m、n均为正整数)( )
| A. | 若G的最高价氧化物水化物为强酸,则J一定是活泼非金属元素 | |
| B. | HnJOm为强酸,则G是位于VA族以后的活泼非金属元素 | |
| C. | 若T的最低化合价为-3,则G的最高正化合价为+6 | |
| D. | 若M的最高正化合价为+4,则五种元素不一定都是非金属元素 |
2.一定温度下的恒容容器中,能标志某可逆反应A(s)+2B(g)?C(g)+D(g)已达平衡状态的是( )
| A. | 混合气体的压强不随时间变化而变化 | |
| B. | 气体总物质的量不随时间变化而变化 | |
| C. | 2v正(B)=v逆(D) | |
| D. | 混合气体的密度保持不变 |

 .
.