题目内容
18.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.如图为N2(g)和O2(g)生成NO(g)过程中的能量变化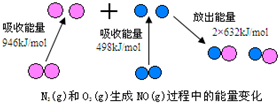
(1)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,则N≡N的键能为946 kJ/mol,由如图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1
(2)根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H.
C(石墨)+O2(g)═CO2(g);△H1=-393.5kJ/mol
2H2(g)+O2(g)═2H2O(l);△H2=-571.6kJ/mol
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H3=-2599.2kJ/mol,
则由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H+226.8 kJ/mol.
分析 (1)根据拆开1mol某化学键所吸收的能量看成该化学键的键能,结合图示即可解答;根据反应热等于反应物的总键能减去生成物的总键能计算,标注物质聚集状态和对应反应的焓变书写热化学方程式;
(2)可以先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式.
解答 解:(1)由图可知:N≡N键的键能为946kJ•mol-1,反应热=反应物总键能-生成物总键能=946kJ•mol-1+498kJ•mol-1-2×632kJ•mol-1=180 kJ•mol-1,热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1;
故答案为:946;N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1;
(2)①已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ•mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599.2kJ•mol-1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$得到,
所以反应焓变△H=2×(-393.5kJ•mol-1)+(-571.6kJ•mol-1)×$\frac{1}{2}$-(-2599.2kJ•mol-1)×$\frac{1}{2}$=+226.8kJ•mol-1,
故答案为:+226.8.
点评 本题考查了反应热的计算,题目难度中等,注意反应热△H的单位与符号、利用键能计算反应焓变、盖斯定律计算应用,掌握基础是解题关键.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | 不用稀硫酸,改用98%浓硫酸 | B. | 加热 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
| A. | 蔗糖 | B. | 油脂 | C. | 葡萄糖 | D. | 蛋白质 |
| A. | 用10mL量筒量取5.26mL稀硫酸 | |
| B. | 用托盘天平称量11.7g氧化铜粉末 | |
| C. | 用广泛pH试纸测得某溶液的pH为3.5 | |
| D. | 用酸式滴定管量取10.5mL盐酸溶液 |
| A. | 蜡炬成灰 | B. | 木已成舟 | C. | 冰雪消融 | D. | 水落石出 |
| A. | 2.4g Mg与Cl2完全反应,失去电子的数目为0.2NA | |
| B. | 标准状况下,NA个SO3分子所占的体积约为22.4L | |
| C. | 1mol Cl2与H2完全反应,转移的电子数目为NA | |
| D. | CO2的摩尔质量等于NA个CO2分子的质量 |
| A. |  | B. |  | C. |  | D. |  |
 .
.