题目内容
(Ⅰ)近年来我国对碳纳米管的研究也有了较大突破,即用电弧合成法来制碳纳米管,但往往有大量的碳纳米颗粒,需用氧化法来提纯这些颗粒,化学方程式为:
□C+□K2Cr2O7+□H2SO4(稀)
CO2↑+□K2SO4+□Cr2(SO4)3+□□试回答下列问题:
(1)完成并配平上述反应的化学方程式.
(2)上述反应若生成11g CO2,则转移电子的数目为 .
□C+□K2Cr2O7+□H2SO4(稀)
| △ |
(1)完成并配平上述反应的化学方程式.
(2)上述反应若生成11g CO2,则转移电子的数目为
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,结合化合价升降总数相等以及质量守恒定律配平;
(2)生成11g CO2,n(CO2)=
=0.25mol,结合C元素的化合价计算转移电子数.
(2)生成11g CO2,n(CO2)=
| 11g |
| 44g/mol |
解答:
解:(1)反应中C元素的化合价由0升高为+4价,一个碳化合价变化4,Cr元素的化合价由+6价降低为+3价,1个K2Cr2O7化合价变化6,4和6的最小公倍数为12,由化合价升降总数相等可知,C的化学计量数为3,K2Cr2O7的化学计量数为2,最后由质量守恒定律可知生成物中还生成水,由原子守恒可知其化学计量数为8,所以该化学反应为3C+2K2Cr2O7+8H2SO4=3CO2+2K2SO4+2Cr2(SO4)3+8H2O,
故答案为:3C+2K2Cr2O7+8H2SO4=3CO2+2K2SO4+2Cr2(SO4)3+8H2O;
(2)生成11g CO2,n(CO2)=
=0.25mol,由C元素的化合价可知转移电子数为0.25mol×(4-0)×NA=NA,故答案为:NA.
故答案为:3C+2K2Cr2O7+8H2SO4=3CO2+2K2SO4+2Cr2(SO4)3+8H2O;
(2)生成11g CO2,n(CO2)=
| 11g |
| 44g/mol |
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应配平及电子转移的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
两种微粒的核外电子数相同,核电荷数不同,则它们可能是( )
| A、两种元素的不同原子 |
| B、两种不同的离子 |
| C、同种元素的原子和离子 |
| D、两种不同元素的分子 |
下列推断正确的是( )
| A、BF3是三角锥形分子 | ||
B、NH
 ,离子呈平面形结构 ,离子呈平面形结构 | ||
| C、CH4分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的s-p σ键 | ||
| D、CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3σ键 |

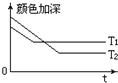 (1)反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,温度(T)之间的关系如图所示(B、C均为无色物质):
(1)反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,温度(T)之间的关系如图所示(B、C均为无色物质):
