题目内容
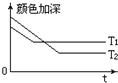 (1)反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,温度(T)之间的关系如图所示(B、C均为无色物质):
(1)反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,温度(T)之间的关系如图所示(B、C均为无色物质):①该反应是
②若A、B、C均为气态物质,增大压强,B的转化率
(2)化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:
NH3+H2O?NH3?H2O?NH4++OH-
①向氨水中加入MgCl2固体时,平衡向
②向浓氨水中加入少量NaOH固体,平衡向
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)①依据图象分析先拐先平温度高,气体颜色加深,说明平衡逆向进行,正反应为放热反应;
②若A、B、C均为气态物质,反应前后气体体积不变,增大压强平衡不动,但混合气体颜色加深;
(2)氨水中存在下列平衡:NH3+H2O?NH3?H2O?NH4++OH-,如果加入能和铵根离子或氢氧根离子反应的物质,平衡就向电离方向移动,如果加入的物质中含有铵根离子或氢氧根离子,平衡向逆反应方向移动,据此分析解答.
②若A、B、C均为气态物质,反应前后气体体积不变,增大压强平衡不动,但混合气体颜色加深;
(2)氨水中存在下列平衡:NH3+H2O?NH3?H2O?NH4++OH-,如果加入能和铵根离子或氢氧根离子反应的物质,平衡就向电离方向移动,如果加入的物质中含有铵根离子或氢氧根离子,平衡向逆反应方向移动,据此分析解答.
解答:
解:(1)反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间关系可知随反应进行气体颜色变浅最后不变达到平衡状态;
①图象分析先拐先平温度高,气体颜色加深,说明平衡逆向进行,正反应为放热反应;
故答案为:放;
②若A、B、C均为气态物质,反应前后气体体积不变,增大压强平衡不动,但混合气体颜色加深;
故答案为:不变,加深;
(2)①氨水中存在下列平衡:NH3+H2O?NH3?H2O?NH4++OH-,向氨水中加入MgCl2固体时,氢氧根离子和镁离子反应生成氢氧化镁沉淀导致氢氧根离子浓度减小,平衡向右移动,铵根离子浓度增大,故答案为:正反应方向;减小;增大;
②向浓氨水中加入少量NaOH固体,导致溶液中氢氧根离子浓度增大,平衡向左移动,氢氧根离子和铵根离子反应生成氨气,所以有刺激性气体逸出,
故答案为:逆反应方向,氨水中有刺激性气体产生;
①图象分析先拐先平温度高,气体颜色加深,说明平衡逆向进行,正反应为放热反应;
故答案为:放;
②若A、B、C均为气态物质,反应前后气体体积不变,增大压强平衡不动,但混合气体颜色加深;
故答案为:不变,加深;
(2)①氨水中存在下列平衡:NH3+H2O?NH3?H2O?NH4++OH-,向氨水中加入MgCl2固体时,氢氧根离子和镁离子反应生成氢氧化镁沉淀导致氢氧根离子浓度减小,平衡向右移动,铵根离子浓度增大,故答案为:正反应方向;减小;增大;
②向浓氨水中加入少量NaOH固体,导致溶液中氢氧根离子浓度增大,平衡向左移动,氢氧根离子和铵根离子反应生成氨气,所以有刺激性气体逸出,
故答案为:逆反应方向,氨水中有刺激性气体产生;
点评:本题考查了化学平衡影响因素,电离平衡的移动,根据勒夏特列原理进行分析解答即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
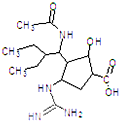 2013年4月5日国家食品药品监督管理局批准了抗H7N9流感新药帕拉米韦氯化钠注射液,帕拉米韦结构如图所示.下列有关说法正确的是( )
2013年4月5日国家食品药品监督管理局批准了抗H7N9流感新药帕拉米韦氯化钠注射液,帕拉米韦结构如图所示.下列有关说法正确的是( )| A、该分子式为C15H28N4O4 |
| B、帕拉米韦能发生取代、加成、消去和氧化反应 |
| C、该分子为难溶于水的药物,遇FeCl3溶液显紫色 |
| D、该分子中含有4种官能团 |
下列离子方程式书写正确的是( )
| A、铝与烧碱溶液反应:Al+2OH-═AlO2-+H2↑ |
| B、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、少量CO2气体通入氢氧化钙溶液中:CO2+2OH -═CO32-+H2O |
| D、氯化铁溶液呈酸性:Fe3++3H2O?Fe(OH)3+3 H+ |
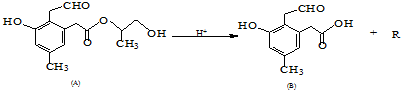
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
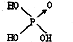
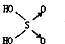
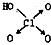
 (1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
(1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示: