题目内容
15.下列反应中,SO2作为氧化剂而发生反应的是( )| A. | 2SO2+O2═2SO3 | B. | SO2+H2O═H2SO3 | ||
| C. | SO2+2H2S═3S↓+2H2O | D. | SO2+Cl2+2H2O═H2SO4+2HCl |
分析 二氧化硫作氧化剂说明得电子,化合价降低,由此分析解答.
解答 解:A、2SO2+O2═2SO3反应中硫的化合价升高,是还原剂,故A错误;
B、SO2+H2O═H2SO3反应中硫的化合价不变,非氧化还原反应,故B错误;
C、SO2+2H2S═3S↓+2H2O反应二氧化硫中硫的化合价降低,是氧化剂,故C正确;
D、SO2+Cl2+2H2O═H2SO4+2HCl反应中硫的化合价升高,是还原剂,故D错误;
故选C.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
14. 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )
 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )| A. | CH2C12有两种同分异构体 | |
| B. | 丙烯能使溴水褪色 | |
| C. | 戊醇在一定条件下能与乙酸发生酯化反应 | |
| D. | 苯与足量氢气在镍催化作用下会发生加成反应生成环己烷 |
6.已知H2O跟H+可结合成H3O+(称为水合氢离子),则H3O+中一定含有的化学键是( )
| A. | 离子键 | B. | 非极性键 | C. | 配位键 | D. | 氢键 |
10.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 金属氧化物 氧化铁 FeO | B. | 非金属氧化物 二氧化硫 SO2 | ||
| C. | 酸 次氯酸 HClO3 | D. | 碱 纯碱 Na2CO3 |
7.a、b、c、d为短周期元素,a的M电子层有l个电子,b的一种核素14b常用于鉴定文物年代,c的最高化合价与最低化合价代数和为4,d的正一价含氧酸能杀菌、消毒、漂白.下列叙述错误的是( )
| A. | 最高价含氧酸酸性:d>c>b | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | c 的单质难溶于水,微溶于酒精,易溶于bc2 | |
| D. | b、c、d分别与氢形成的化合物中化学键均为极性共价键 |
4.Mg(OH)2在水中达到溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
| A. | 加入MgCl2溶液 | B. | 加入少量NaOH | C. | 加入NH4NO3溶液 | D. | 加入K2S溶液 |
5.我国科研人员以Zn和尖晶石百锰酸锂(ZnMn2O4)为电极材料,研制出一种水系锌离子电池.该电池的总反应方程式:xZn+Zn1-xMn2O4$?_{充电}^{放电}$ZnMn2O4(0<x<1).下列说法正确的是( )
| A. | ZnMn2O4是负极材料 | |
| B. | 充电时,Zn2+向ZnMn2O4电极迁移 | |
| C. | 充电时,阳极反应:ZnMn2O4-xZn2+-2xe-=Zn1-x Mn2O4 | |
| D. | 充放电过程中,只有Zn元素的化合价发生变化 |
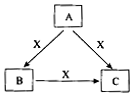 A、B、C、X是中学化学常见化合物,均由短周期元素组成,转化关系如图所示. 若A、B、C的焰色反应均呈黄色,水溶液均为碱性.
A、B、C、X是中学化学常见化合物,均由短周期元素组成,转化关系如图所示. 若A、B、C的焰色反应均呈黄色,水溶液均为碱性.