题目内容
20.用铁氰化钾溶液检验溶液中的Fe2+的原理:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(用离子方程说明原理).分析 铁氰化酸根离子与二价铁离子生成铁氰化亚铁沉淀,为蓝色沉淀,以此解答该题.
解答 解:铁氰化酸根离子与二价铁离子生成铁氰化亚铁沉淀,离子方程式:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓;
故答案为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
点评 本题考查物质的检验以及离子方程式的书写,为高频考点,注意把握相关物质的性质以及离子反应的特点,把握离子方程式的书写方法,难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
19.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
| A. | 1.8gH2O与CH2D2的混合物中所含质子数为NA | |
| B. | 1mol甲烷或白磷(P4)分子中所含共价键数均为4NA | |
| C. | 1mol CH3COOC2H5在稀硫酸溶液中水解可得到乙醇分子数为NA | |
| D. | 25℃时,l L pH=1的H2SO4溶液中含有的H+ 数为0.2NA |
11.能用勒夏特列原理解释的是( )
| A. | 煅烧粉碎的硫铁矿有利于SO2生成 | |
| B. | 由H2、I2、HI三种气体组成的平衡体系加压后颜色变深 | |
| C. | 使用铁触媒,有利于N2和H2的混合气体合成NH3 | |
| D. | 实验室常用排饱和和食盐水法收集Cl2 |
15.下列反应中,SO2作为氧化剂而发生反应的是( )
| A. | 2SO2+O2═2SO3 | B. | SO2+H2O═H2SO3 | ||
| C. | SO2+2H2S═3S↓+2H2O | D. | SO2+Cl2+2H2O═H2SO4+2HCl |
5.下列关于丙烯(CH3CH=CH2)的说法正确的是( )
| A. | 丙烯分子有6个δ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子中既存在极性键又存在非极性键 | |
| D. | 丙烯分子中所有原子在同一平面上 |
12.银器的保护主要是维持它的原貌,对于轻微腐蚀蒙有硫化银的银器,可将其和铝片一起接触浸泡在稀NaOH溶液中,经一定时间污迹消失,取出后用水洗于净,再用软布或棉团擦光.有关叙述正确的是( )
| A. | 溶液中的OH-离子向正极移动 | |
| B. | 在银表面上的反应为:Ag2S+2e-═2Ag+S2- | |
| C. | 反应后容易的pH增大 | |
| D. | 在铝表面的反应为:Al+4OH--3e-═AlO2-+2H2O |
9.某无色溶液中,由水电离出的c(H+)=1×10-14mo1•L-1,则该溶液中,一定能大量共存的离子组是( )
| A. | K+、Na+、MnO4-、SO42- | B. | K+、Cl-、Ba2+、HCO3- | ||
| C. | K+、Na+、Cl-、Br- | D. | Na+、CO32-、A1O2-、C1- |
5.A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示.则下列说法正确的是( )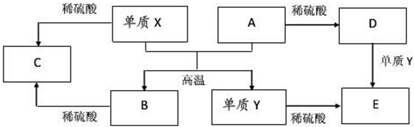

| A. | 单质X与A反应的化学方程式:Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al | |
| B. | 检验D溶液中金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓ | |
| C. | 单质X和单质Y在一定条件下均能与水发生置换反应 | |
| D. | 由于化合物B和C均既能与酸反应,又能与碱反应,所以两者均是两性氧化物 |
 .
.