题目内容
14.下列装置或操作能达到实验目的是( )| A. |  分离乙酸和乙醇 | B. |  构成锌铜原电池 | C. |  制备乙酸乙酯 | D. |  制备蒸馏水 制备蒸馏水 |
分析 A.乙醇与乙酸互溶;
B.酒精为非电解质;
C.乙醇与乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯,饱和碳酸钠溶液可吸收乙醇、乙酸,降低乙酸乙酯的溶解度,且导管口在液面上可防止倒吸;
B.蒸馏时温度计测定馏分的温度,冷水下进上出.
解答 解:A.乙醇与乙酸互溶,则不能利用分液漏斗分液,应选蒸馏法,故A错误;
B.酒精为非电解质,不导电,不能构成原电池,故B错误;
C.乙醇与乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯,饱和碳酸钠溶液可吸收乙醇、乙酸,降低乙酸乙酯的溶解度,且导管口在液面上可防止倒吸,装置合理,故C正确;
B.蒸馏时温度计测定馏分的温度,冷水下进上出,图中温度计的水银球在支管口处、冷水方向合理,故D正确;
故选CD.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、原电池及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| B. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 | |
| C. |  分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
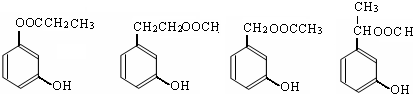
| D. | 1mol有机物  一定条件下能和7molNaOH反应 一定条件下能和7molNaOH反应 |
5.下列反应的离子方程式正确的是( )
| A. | 向银氨溶液中加入足量氢溴酸溶液:Ag(NH3)2++OHˉ+3H+═Ag++2NH4++H2O | |
| B. | 向0.1 mol/L pH=1的NaHA的溶液中加入NaOH溶液:HA-+OH-═H2O+A2- | |
| C. | H2C2O4使酸性KMnO4溶液褪色:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:2Ba2++2SO42-+4OH-+Al3+═2BaSO4↓+AlO2-+2H2O |
2.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 铝和盐酸反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 氢气还原氧化铜 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
9.关于钠及其化合物的性质的叙述,正确的是( )
| A. | 碳酸钠可用于治疗胃酸过多,作胃酸中和剂 | |
| B. | 氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同 | |
| C. | 碳酸钠固体中混有少量碳酸氢钠,可用加热的方法除去 | |
| D. | 质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,后者产生气体少 |
19.下列实验操作能达到相应实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化硫具有漂白性 |
| B | 验证电离H+的能力HClO>HCO3- | 向 NaHCO3溶液中加入新制氯水,观察溶液中是否有气泡冒出 |
| C | 相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴84消毒液,观察红色褪色的快慢 | 证明随溶液pH的减少,84消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
3.如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定).

试回答下列问题:
(1)实验1中,沉淀最终变为红褐色色,写出生成白色沉淀的离子方程式:Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+.
(2)实验2中,甲中最后剩余的无色气体是NO,写出NO2与H2O反应的化学方程式3NO2+H2O═2HNO3+NO.
(3)实验3中,已知:3Cl2+2NH3═N2+6HCl.甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为黄绿色变为无色,最后针筒内剩余气体的体积约为5mL.

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒 的现象 |
| 1 | 10mL FeSO4溶液 | 10mL NH3 | 生成白色沉淀,后变色 |
| 2 | 30mL NO2 | 10mL H2O(l) | 剩无色气体 |
| 3 | 15mL Cl2 | 40mL NH3 |
(1)实验1中,沉淀最终变为红褐色色,写出生成白色沉淀的离子方程式:Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+.
(2)实验2中,甲中最后剩余的无色气体是NO,写出NO2与H2O反应的化学方程式3NO2+H2O═2HNO3+NO.
(3)实验3中,已知:3Cl2+2NH3═N2+6HCl.甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为黄绿色变为无色,最后针筒内剩余气体的体积约为5mL.
4.下列说法错误的是( )
| A. | 催化剂可以改变化学反应速率 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 2molSO2与 1molO2一定能生成2molSO3 | |
| D. | 锌与稀硫酸反应时,加入少量铜粉能加快反应 |

 或
或 .
. (其中一种).
(其中一种).