题目内容
8.实验室用氢氧化钠固体配制0.5mol L-1的NaOH溶液500mL,回答下列问题:(1)完成本实验中所必需的仪器有:托盘天平(精确到0.1g)药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管.
(2)计算配制溶液所需要NaOH固体的质量为10.0克.
(3)请将下列各操作,按正确的序号填在横线上.
A.称取NaOH固体 B.反复颠倒摇匀
C.恢复至室温 D.用胶头滴管加蒸馏水至刻度线
E.溶解NaOH固体 F.将溶液转入容量瓶
其操作正确的顺序依次为AECFDB.
(4)下列操作对所配溶液的浓度有何影响?(填写字母)
偏大的有AC;偏小的有BDEFH;无影响的有G.
A.定容时俯视刻度线 B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶中移液时,有少量液体溅出 E.未洗涤溶解NaOH 的烧杯
F.定容时仰视刻度线 G.容量瓶未干燥即用来配制溶液
H.定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线.
分析 (1)依据配制一定物质的量浓度溶液步骤选择需要仪器;
(2)依据m=CVM计算需要溶质的质量;
(3)配制一定物质的量浓度溶液步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,据此排序;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,用到的仪器依次为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少的仪器:烧杯、玻璃棒、500mL容量瓶、胶头滴管;
故答案为:烧杯、玻璃棒、500mL容量瓶、胶头滴管;
(2)用氢氧化钠固体配制0.5mol L-1的NaOH溶液500mL,需要氢氧化钠的质量为:0.5mol/L×0.5L×40g/mol=10.0g;
故答案为:10.0;
(3)配制一定物质的量浓度溶液步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的步骤为:AECFDB;
故答案为:AECFDB;
(4)A.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
B.将NaOH放在纸张上称量,导致称取的溶质质量偏小,溶质的物质的量偏小,溶液浓度偏低;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高;
D.往容量瓶中移液时,有少量液体溅出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
E.未洗涤溶解NaOH 的烧杯,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
F.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低;
G.容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变;
H.定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:AC、BDEFH、G.
点评 本题考查了一定物质的量浓度溶液配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | 2Na+2H2O=2NaOH+H2↑是酸碱反应 | |
| B. | ClO-+H2O?HClO+OH-是酸碱反应 | |
| C. | 碱性强弱顺序:OH->ClO->CH3COO- | |
| D. | HCO3-既是酸又是碱,NH3既不是酸又不是碱 |
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 蒸发结晶时应将溶液完全蒸干 | |
| D. | 洗涤沉淀的方法是向漏斗中加水,使水没过沉淀,等水流完后再重复操作几次 |
| M | N | ||
| X | Y |
| A. | 元素的第一电离能X<Y | |
| B. | X位于第三周期 IIA,其单质可采用电解熔融其氯代物制备 | |
| C. | 元素最高价氧化物的水化物中,酸性最强的是HNO3 | |
| D. | 气体分子(MN)2的电子式为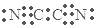 |
| A. | 用湿润的蓝色石蕊试纸检验某种气体是否是NH3 | |
| B. | 某种有色溶液可使淀粉-KI试纸变蓝色,则该溶液中一定含有Fe3+ | |
| C. | 用玻璃棒蘸取溶液点在用蒸馏水湿润过的pH试纸上可测量该溶液的pH | |
| D. | 将湿润的蓝色石蕊试纸片粘在玻璃棒上置于氯气中,试纸先变红后褪色 |
| A. |  塑料直尺 | B. |  尼龙提包 | C. |  纯羊毛手套 | D. |  塑胶地垫 |
 .
.