题目内容
16.0.5mol K2SO4溶于水可电离出1mol K+,溶液中含SO${\;}_{4}^{2-}$48g,某一定量K2SO4溶液中含7.8g K+,则溶液中含K2SO4 0.1mol,SO${\;}_{4}^{2-}$的个数约0.1NA个.分析 每个硫酸钾化学式电离生成2个钾离子、1个硫酸根离子,根据m=nM计算硫酸根离子质量;n(K+)=$\frac{7.8g}{39g/mol}$=0.2mol,硫酸钾中钾离子和硫酸钾的物质的量之比为2:1,钾离子和硫酸根离子个数之比为2:1,根据N=nNA计算硫酸根离子个数.
解答 解:每个硫酸钾化学式电离生成2个钾离子、1个硫酸根离子,则0.5mol K2SO4溶于水可电离出n(K+)=2n(K2SO4)=0.5mol×2=1mol;n(SO42-)=n(K2SO4)=0.5mol,m(SO42-)=nM=0.5mol×96g/mol=48g;
n(K+)=$\frac{7.8g}{39g/mol}$=0.2mol,硫酸钾中钾离子和硫酸钾的物质的量之比为2:1,钾离子和硫酸根离子个数之比为2:1,所以n(K2SO4)=n(SO42-)=$\frac{1}{2}$n(K+)=$\frac{1}{2}$×0.2mol=0.1mol,N(SO42-)=0.1mol×NA/mol=0.1NA,
故答案为:1;48;0.1;0.1NA.
点评 本题考查物质的量的有关计算,为高频考点,明确各个物理量之间关系是解本题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.在高温下,用一氧化碳还原m g氧化铁,得到n g铁,已知氧的相对原子质量为16,则铁的相对原子质量为( )
| A. | $\frac{24n}{m-n}$ | B. | $\frac{n}{24(m-n)}$ | C. | $\frac{m-n}{8}$ | D. | $\frac{2(m-n)}{3n}$ |
7.下列关于糖类物质的叙述中,正确的是( )
| A. | 纤维素被人体消化吸收后提供营养物质 | |
| B. | 能发生水解反应的不一定是糖类,但糖类一定能发生水解反应 | |
| C. | 没有成熟的苹果汁遇碘变蓝色,成熟的苹果汁能还原新制氢氧化铜悬浊液 | |
| D. | 1 mol二糖完全水解一定能够生成2 mol葡萄糖 |
4.1999年4月,比利时查出污染鸡的根源是生产鸡饲料的油脂被二恶英所污染,二恶英是两大芳香族化合物的总称.其中四氯代二苯并二恶英毒性最大,其结构简式为 :下列有关该化合物的说法中正确的是( )
:下列有关该化合物的说法中正确的是( )
 :下列有关该化合物的说法中正确的是( )
:下列有关该化合物的说法中正确的是( )| A. | 分子式为C12H8O2Cl4 | B. | 是一种可溶于水的气体 | ||
| C. | 是最危险的致癌物之一 | D. | 是一种多卤代烃 |
5.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 10mL 0.5mol•L-1 CH3COONa 与6mL 1mol•L-1 盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]>c[(NH4)2CO3]>c(NH4Cl) |

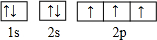 ,这样排布遵循了构造原理、泡利原理和洪特规则.
,这样排布遵循了构造原理、泡利原理和洪特规则.