题目内容
4.1999年4月,比利时查出污染鸡的根源是生产鸡饲料的油脂被二恶英所污染,二恶英是两大芳香族化合物的总称.其中四氯代二苯并二恶英毒性最大,其结构简式为 :下列有关该化合物的说法中正确的是( )
:下列有关该化合物的说法中正确的是( )| A. | 分子式为C12H8O2Cl4 | B. | 是一种可溶于水的气体 | ||
| C. | 是最危险的致癌物之一 | D. | 是一种多卤代烃 |
分析 A、根据结构简式以及各元素能形成共价键的数目判断分子式是否正确;
B、根据相似相溶原理分析判断;
C、四氯代二苯并二恶英毒性最大;
D、根据多卤代烃是分子中含有两个或两个以上卤素原子的卤代烃叫做多卤代烃,氯代烃分子中不含有氧元素.
解答 解:A、由结构简式可知该有机物的分子式为C12H402Cl4,故A错误;
B、由相似相溶原理知,有机溶质易溶于有机溶剂,该物质是有机物,水是无机物,所以该物质不易溶于水,故B错误;
C、二噁英是致癌物,四氯代二苯二恶英毒性最大,所以是最危险的致癌物之一,故C正确;
D、二噁英分子中含有氧元素,不属于多卤代烃,故D错误;
故选:C.
点评 本题考查有机物的结构和性质,侧重于学生综合运用化学知识的能力的考查,注意把握多卤代烃的概念,题目难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
15.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)元素T的最高价含氧酸具有强酸性;T在周期表中的位置是第三周期第ⅦA族.
(2)化合物甲的分子由两个J原子和两个氢原子构成,甲的电子式是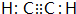 .
.
(3)一定条件下,R元素的最高价氧化物乙在固定容积的密闭容器中发生分解反应(△H>0),达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增,y递减的是ac(选填序号)
(4)L的最简单气态氢化物丙的水溶液显碱性,在微电子工业中,丙的水溶液可作H2O2的清除剂,反应的产物不污染环境,其化学方程式为NH3+3H2O2=N2+6H2O.
(5)在298K下,J、M的单质各1mol完全燃烧,分别放出热量以akJ和bkJ时.又知一定条件下,M的单质能将J从它的最高价氧化物中置换出来,写出此置换反应的热化学方程式:4Al(s)+3CO2(g)=3C(s)+2Al2O3(s)△H=(+3a-4b)kJ/mol.(注:题中所设单质均为最稳定单质)
(6)用M单质作阳极,J单质作阴极,Ca(HCO3)2溶液作电解液,进行电解,阴极生成的气体和沉淀分别是H2、CaCO3,阳极也生成气体和沉淀,写出阳极的电极反应式Al-3e-+3HCO3-=Al(OH)3+3CO2↑.
| J | ||||
| R |
(2)化合物甲的分子由两个J原子和两个氢原子构成,甲的电子式是
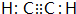 .
.(3)一定条件下,R元素的最高价氧化物乙在固定容积的密闭容器中发生分解反应(△H>0),达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增,y递减的是ac(选填序号)
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入氧气 | 加入乙的物质 |
| y | 乙的物质的量 | 平衡常数K | 乙的转化率 | 生成物物质的量总和 |
(5)在298K下,J、M的单质各1mol完全燃烧,分别放出热量以akJ和bkJ时.又知一定条件下,M的单质能将J从它的最高价氧化物中置换出来,写出此置换反应的热化学方程式:4Al(s)+3CO2(g)=3C(s)+2Al2O3(s)△H=(+3a-4b)kJ/mol.(注:题中所设单质均为最稳定单质)
(6)用M单质作阳极,J单质作阴极,Ca(HCO3)2溶液作电解液,进行电解,阴极生成的气体和沉淀分别是H2、CaCO3,阳极也生成气体和沉淀,写出阳极的电极反应式Al-3e-+3HCO3-=Al(OH)3+3CO2↑.
12.某学习小组研究同周期元素性质递变规律时,设计并进行了下列实验(表中的“实验步骤”与“实验现象”前后不一定是对应关系).
(1)请将各实验步骤对应的实验现象填写入下表中:
(2)此实验可得出的结论是:
Na、Mg、Al金属性强弱关系:Na>Mg>Al,Cl、S非金属性强弱关系:Cl>S.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
| 实验步骤 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | C | D |
Na、Mg、Al金属性强弱关系:Na>Mg>Al,Cl、S非金属性强弱关系:Cl>S.
19.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | W的单质可用于制造光导纤维 |
9.某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)甲同学认为根据所学知识:已知硫化铜(CuS)、硫化亚铜(Cu2S)、粉末和氧化铜粉末相似且都不溶于水,在空气中煅烧硫化铜和硫化亚铜都转化二种氧化物,设计一个不用任何化学试剂就能鉴别氧化铜、硫化铜、硫化亚铜三种粉末的简便实验方案,请帮助甲同学将方案填写于下表中,实验提供天平及其他必要的设备.
(2)乙同学查阅文献得知检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.该同学假设黑色沉淀是CuO.检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(3)丙同学再次假设,黑色沉淀是铜的硫化物.实验如下:
①现象2说明黑色沉淀具有还原性.
②能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
(4)丁同学通过实验确认,固体只含有硫化铜和硫化亚铜,他通过以下实验求硫化亚铜的百分含量:取2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应.
则混合物中Cu2S的质量分数为40%.
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)甲同学认为根据所学知识:已知硫化铜(CuS)、硫化亚铜(Cu2S)、粉末和氧化铜粉末相似且都不溶于水,在空气中煅烧硫化铜和硫化亚铜都转化二种氧化物,设计一个不用任何化学试剂就能鉴别氧化铜、硫化铜、硫化亚铜三种粉末的简便实验方案,请帮助甲同学将方案填写于下表中,实验提供天平及其他必要的设备.
| 实验步骤 | 实验现象 | 结论及有关化学方程式 |
| A.分别称取相同质量的样品,在空气中燃烧; B.分别称量硫化铜和硫化亚铜灼烧后剩余物质的质量 | A.有一种固体无变化,两种固体产生刺激性气味气体 B.有一种样品质量减轻,一种样品质量不变 | A.固体无变化的是氧化铜,产生刺激性气味气体的是硫化铜和硫化亚铜,在空气中煅烧中反应的化学方程式分别为2CuS+3O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2; Cu2S+2O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 B.质量减轻的是硫化铜,质量不变的是硫化亚铜 |
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是黑色沉淀中不含有CuO.
(3)丙同学再次假设,黑色沉淀是铜的硫化物.实验如下:
| 实验装置 | 现象 |
 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②能确认黑色沉淀中含有S元素的现象是B试管中出现白色沉淀,相应的离子方程式是NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+.
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物.
以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+4SO2↑+4H2O.
(4)丁同学通过实验确认,固体只含有硫化铜和硫化亚铜,他通过以下实验求硫化亚铜的百分含量:取2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应.
则混合物中Cu2S的质量分数为40%.
16.下列说法正确的是( )
| A. | 凡是分子组成相差一个或几个“CH2”原子团的物质,彼此一定是同系物 | |
| B. | 两种化合物的组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 | |
| C. | 凡是含碳元素的化合物都属于有机化合物 | |
| D. | 有机化合物的同分异构现象是有机化合物种类繁多的重要原因之一 |
13.石墨是层状晶体,每一层内碳原子排列成正六边形,一个个正六边形排列成平面网状结构,如果将每对相邻碳原子间的短线看成一个化学键,则石墨晶体中每一层内碳原子数与C-C键数的比是( )
| A. | 2:3 | B. | 1:3 | C. | 1:1 | D. | 1:2 |
14.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
| A. | 10℃20 mL 3 mol•L-1的盐酸溶液 | B. | 20℃30 mL 2 mol•L-1的盐酸溶液 | ||
| C. | 20℃20 mL 2 mol•L-1的盐酸溶液 | D. | 20℃10 mL 4 mol•L-1的盐酸溶液 |