题目内容
实验室测量KMnO4溶液浓度时常用(NH4)2Fe(SO4)2代替FeSO2作标液,(NH4)2Fe(SO4)2的制备工艺流程如下:

(l) 已知流程中铁粉制备反应如下:
4H2 O(g)+3Fe(s)═Fe3O4(s)十4H2(g)△H=a kJ/mol
Fe3O4(s)=3Fe(s)+2O2(g)△H=b kJ/mol
则光解气态水制备H2的热化学方程式为 .
(2)步骤I中加水发生如下反应,请完善该反应: +2H2O═2H++H2TiO3↓;该步骤加入铁粉的作用是① ;② .
(3)步骤Ⅳ生成(NH4)2Fe(SO4)2,其化学反应方程式为_ ;操作I为 .
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化.据此分析(NH4)2Fe(SO4)2比FeSO4稳定的原因是 .

(l) 已知流程中铁粉制备反应如下:
4H2 O(g)+3Fe(s)═Fe3O4(s)十4H2(g)△H=a kJ/mol
Fe3O4(s)=3Fe(s)+2O2(g)△H=b kJ/mol
则光解气态水制备H2的热化学方程式为
(2)步骤I中加水发生如下反应,请完善该反应:
(3)步骤Ⅳ生成(NH4)2Fe(SO4)2,其化学反应方程式为_
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化.据此分析(NH4)2Fe(SO4)2比FeSO4稳定的原因是
考点:制备实验方案的设计,用盖斯定律进行有关反应热的计算
专题:实验题,化学反应中的能量变化
分析:FeSO4(含有TiOSO4)中加水和过量铁粉,TiO2+水解生成H2TiO3沉淀,过滤得到的滤渣为H2TiO3,滤液为硫酸亚铁溶液,在滤液中加(NH4)2SO4,生成(NH4)2Fe(SO4)2,对溶液进行蒸发浓缩、冷却结晶、过滤即可得到(NH4)2Fe(SO4)2晶体;
(1)把已知的热化学方程式相加即得到水分解的热化学方程式;
(2)TiO2+水解生成H2TiO3沉淀;Fe粉能防止亚铁离子被氧化,Fe消耗氢离子能促进TiO2+水解;
(3)在FeSO4溶液中加(NH4)2SO4会生成(NH4)2Fe(SO4)2;操作I为从溶液中提取溶质的操作;
(4)由题中信息可知亚铁离子在碱性条件下易被氧化.
(1)把已知的热化学方程式相加即得到水分解的热化学方程式;
(2)TiO2+水解生成H2TiO3沉淀;Fe粉能防止亚铁离子被氧化,Fe消耗氢离子能促进TiO2+水解;
(3)在FeSO4溶液中加(NH4)2SO4会生成(NH4)2Fe(SO4)2;操作I为从溶液中提取溶质的操作;
(4)由题中信息可知亚铁离子在碱性条件下易被氧化.
解答:
解:FeSO4(含有TiOSO4)中加水和过量铁粉,TiO2+水解生成H2TiO3沉淀,过滤得到的滤渣为H2TiO3,滤液为硫酸亚铁溶液,在滤液中加(NH4)2SO4,生成(NH4)2Fe(SO4)2,对溶液进行蒸发浓缩、冷却结晶、过滤即可得到(NH4)2Fe(SO4)2晶体;
(l) 已知:
①4H2 O(g)+3Fe(s)═Fe3O4(s)十4H2(g)△H=a kJ/mol
②Fe3O4(s)=3Fe(s)+2O2(g)△H=b kJ/mol
由盖斯定律:(①+②)×
得H2 O(g)=H2(g)+
O2(g)△H=
×(a+b)=
(a+b)kJ/mol;
故答案为:H2 O(g)=H2(g)+
O2(g)△H=
(a+b)kJ/mol;
(2)TiO2+水解生成H2TiO3沉淀,其水解的离子方程式为:TiO2++2H2O═2H++H2TiO3↓;亚铁离子在溶液中易被氧化,加Fe粉能防止亚铁离子被氧化,Fe消耗溶液中的氢离子能促进TiO2+水解;
故答案为:TiO2+;防止Fe2+被氧化为Fe3+;消耗溶液中的H+促进TiO2+水解;
(3)在FeSO4溶液中加(NH4)2SO4会生成(NH4)2Fe(SO4)2,其反应方程式为:(NH4)2SO4+FeSO4=(NH4)2Fe(SO4)2;操作I为从溶液中提取溶质的操作,为蒸发浓缩、冷却结晶;
故答案为:(NH4)2SO4+FeSO4=(NH4)2Fe(SO4)2;蒸发浓缩、冷却结晶;
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化,说明二价铁离子在碱性条件下易被氧化,(NH4)2Fe(SO4)2在溶液中电离出来的铵根离子和二价铁离子均发生水解,水解后的溶液的酸性强于FeSO4,则(NH4)2Fe(SO4)2的还原性小于FeSO4,所以更稳定;
故答案为:由题意可知二价铁离子在碱性条件下更易被氧化,(NH4)2Fe(SO4)2水解后的酸性强于FeSO4,则(NH4)2Fe(SO4)2的还原性小于FeSO4,所以更稳定.
(l) 已知:
①4H2 O(g)+3Fe(s)═Fe3O4(s)十4H2(g)△H=a kJ/mol
②Fe3O4(s)=3Fe(s)+2O2(g)△H=b kJ/mol
由盖斯定律:(①+②)×
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 4 |
故答案为:H2 O(g)=H2(g)+
| 1 |
| 2 |
| 1 |
| 4 |
(2)TiO2+水解生成H2TiO3沉淀,其水解的离子方程式为:TiO2++2H2O═2H++H2TiO3↓;亚铁离子在溶液中易被氧化,加Fe粉能防止亚铁离子被氧化,Fe消耗溶液中的氢离子能促进TiO2+水解;
故答案为:TiO2+;防止Fe2+被氧化为Fe3+;消耗溶液中的H+促进TiO2+水解;
(3)在FeSO4溶液中加(NH4)2SO4会生成(NH4)2Fe(SO4)2,其反应方程式为:(NH4)2SO4+FeSO4=(NH4)2Fe(SO4)2;操作I为从溶液中提取溶质的操作,为蒸发浓缩、冷却结晶;
故答案为:(NH4)2SO4+FeSO4=(NH4)2Fe(SO4)2;蒸发浓缩、冷却结晶;
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化,说明二价铁离子在碱性条件下易被氧化,(NH4)2Fe(SO4)2在溶液中电离出来的铵根离子和二价铁离子均发生水解,水解后的溶液的酸性强于FeSO4,则(NH4)2Fe(SO4)2的还原性小于FeSO4,所以更稳定;
故答案为:由题意可知二价铁离子在碱性条件下更易被氧化,(NH4)2Fe(SO4)2水解后的酸性强于FeSO4,则(NH4)2Fe(SO4)2的还原性小于FeSO4,所以更稳定.
点评:本题考查了盖斯定律的应用、物质的制备、物质的分离等实验操作,侧重于学生的分析能力、实验能力的考查,分析流程掌握物质性质和实验基本操作是解题关键,题目难度中等.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
下列物质的稀溶液中,溶质的阴、阳离子个数之比为2:1的是( )
| A、Na2HPO4 |
| B、NaHSO4 |
| C、(NH4)2SO4 |
| D、K2S |
下列说法中正确的是( )
| A、摩尔是用于计量微观粒子集体的物理量 |
| B、CO2的摩尔质量为44g |
| C、0.5mol水中约含6.02×1023个H |
| D、标准状况下1 mol任何物质体积均为22.4L |
A、B、C、D四种金属,将AB用导线连接后,浸在稀硫酸中,在A上有氢气放出,而B溶解;当活泼金属浸在含有A和C两种金属离子可溶性盐溶液里时,在活泼金属上先析出C,把D放入B的硝酸盐溶液中,则D表面有B析出.这四种金属的活动性由强到弱的顺序是( )
| A、A>B>C>D |
| B、D>B>A>C |
| C、D>C>B>A |
| D、D>B>C>A |
下列有关电化学中的化学用语,说法正确的是( )
| A、用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ |
| B、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、粗铜精炼时,与电源正极相连的是纯铜,正极反应式为:Cu2++2e-═Cu |
| D、钢铁发生电化学腐蚀的正极反应式:Fe═Fe2++2e- |
下列物质的分子正负电荷重心不相重合的是( )
| A、C2H2 |
| B、CO2 |
| C、NH3 |
| D、BF3 |
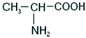 属于α-氨基酸);
属于α-氨基酸);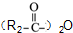 →
→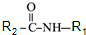 +R2COOH
+R2COOH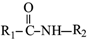 +NaOH→R1COONa+R2NH2
+NaOH→R1COONa+R2NH2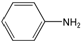 呈弱碱性,易被氧化
呈弱碱性,易被氧化 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 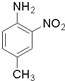 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
 ,所需溴代烃的结构简式为
,所需溴代烃的结构简式为